Número de massa do que consiste e como obtê -lo (com exemplos)
- 2747
- 105
- Alfred Kub
Ele Número de massa o Número de massa de um átomo é a soma do número de prótons e a quantidade de nêutrons do núcleo. Essas partículas são designadas de forma intercambiável com o nome de Nucleonas, Portanto, o número de massa representa a quantidade deles.
Deixe n o número de nêutrons presentes e z o número de prótons, se chamarmos como o número de massa, então:
A = n + z
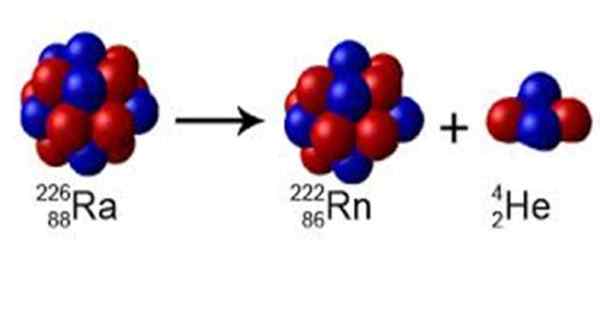
 figura 1. O rádio tem um número de massa A = 226, ele decai em Radon com A = 222 e emite um núcleo de hélio de A = 4. Fonte: Wikimedia Commons. Perox [CC0] [TOC]
figura 1. O rádio tem um número de massa A = 226, ele decai em Radon com A = 222 e emite um núcleo de hélio de A = 4. Fonte: Wikimedia Commons. Perox [CC0] [TOC]
Exemplos de números de massa
Imediatamente alguns exemplos de números de massa para elementos bem conhecidos:
Hidrogênio
O átomo de hidrogênio mais estável e abundante também é o mais simples: 1 próton e um elétron. Como o núcleo de hidrogênio não tem nêutrons, é verdade que a = z = 1.
Oxigênio
Um núcleo de oxigênio tem 8 nêutrons e 8 prótons, portanto a = 16.
Carbono
A vida na Terra é baseada na química do carbono, um átomo de luz com 6 prótons em seu núcleo mais 6 nêutrons, como a = 6 + 6 = 12.
Urânio
Este elemento pesado que os anteriores é bem conhecido por suas propriedades radioativas. O núcleo de urânio tem 92 prótons e 146 nêutrons. Então, seu número de massa é A = 92 + 146 = 238.
Como obter o número de massa?
Como dito antes, o número de massa A de um elemento sempre corresponde à soma do número de prótons e ao número de nêutrons que contêm seu núcleo. É também um número inteiro, mas ... existe alguma regra em termos de relação entre ambas as quantidades?
Vamos ver: todos os elementos mencionados acima são leves, exceto urânio. O átomo de hidrogênio é, como dissemos, o mais simples. Não possui nêutrons, pelo menos em sua versão mais abundante, e em oxigênio e carbono, há um número igual de prótons e nêutrons.
Pode atendê -lo: qual é a limpeza de emissão? (Com exemplos)Isso também acontece com outros elementos leves, como o nitrogênio, outro gás muito importante para a vida, que tem 7 prótons e 7 nêutrons. No entanto, como o núcleo é mais complexo e os átomos se tornam mais pesados, o número de nêutrons está aumentando com outro ritmo.
Ao contrário dos elementos leves, o urânio, com 92 prótons, tem aproximadamente 1 ½ vezes essa quantidade em nêutrons: 1 ½ x 92 = 1.5 x 92 = 138.
Como você pode ver, é bem perto de 146, a quantidade de nêutrons que tem.
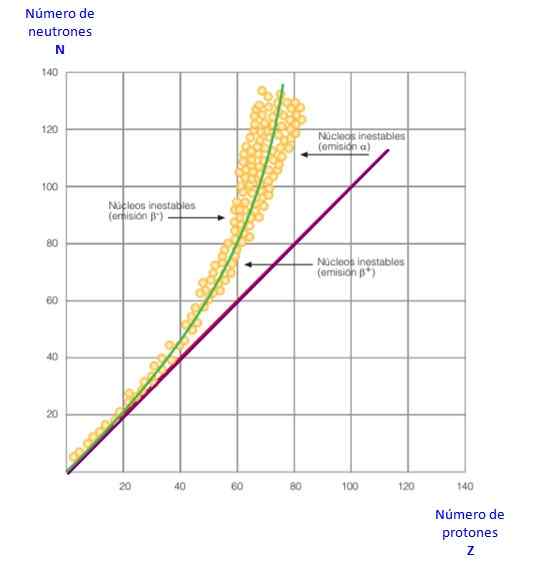 Figura 2. Curva de estabilidade. Fonte: f. Zapata.
Figura 2. Curva de estabilidade. Fonte: f. Zapata. Tudo isso se torna evidente na curva da Figura 2. É um gráfico de n versus z, conhecido como Curva de estabilidade nuclear. Lá pode ser visto como os átomos de luz têm o mesmo número de prótons que o nêutron e como z = 20 o número de nêutrons está aumentando.
Dessa maneira, o grande átomo se torna mais estável, já que o excesso de nêutrons diminui a repulsão eletrostática entre prótons.
Notação para átomos
Uma notação muito útil que descreve rapidamente o tipo de átomo é a seguinte: o símbolo do elemento e os respectivos números atômicos e de massa são escritos como mostrado abaixo neste esquema:
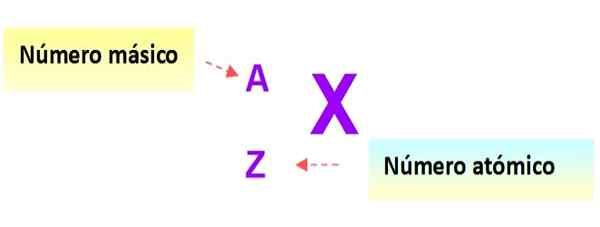 Figura 3. Notação do átomo. Fonte: f. Zapata.
Figura 3. Notação do átomo. Fonte: f. Zapata. Nesta notação, os átomos dos exemplos anteriores seriam:

Às vezes, outra notação mais confortável é usada, na qual apenas o símbolo do elemento e o número de massa para denotar o átomo é usado, omitindo o número atômico. Dessa forma, o 12 6C é escrito simplesmente como carbono-12, o 16 8Ou seria oxigênio-16 e, portanto, para qualquer elemento.
Pode servir a você: semicírculo: como calcular o perímetro, área, centróide, exercíciosOs isótopos
O número de prótons em um núcleo determina a natureza do elemento. Por exemplo, todo átomo cujo núcleo contém 29 prótons é um átomo de cobre, o que quer que aconteça.
Suponha que um átomo de cobre perde um elétron por qualquer motivo, mas ainda é cobre. No entanto, agora é um átomo ionizado.
É mais difícil para um núcleo atômico ganhar ou perder um próton, mas na natureza pode ocorrer. Por exemplo, dentro das estrelas, são continuamente formados elementos mais pesados de elementos leves, já que o núcleo estrela se comporta como um reator de fusão.
E aqui na terra, há o fenômeno do Desintegração radioativa, em que alguns átomos instáveis expulsa os núcleos e emitem energia, transformando -se em outros elementos.
Finalmente, existe a possibilidade de que um átomo de um certo elemento tenha um número de massa diferente, neste caso é um isótopo.
Um bom exemplo é o conhecido carbon-14 ou radiocarbono, que é usado para namorar objetos arqueológicos e como um traçador bioquímico. Este é o mesmo carbono, com propriedades químicas idênticas, mas com dois nêutrons extras.
Carbon-14 é menos abundante que o carbono-12, o isótopo estável e também é radioativo. Isso significa que, com o tempo, ele decai emitindo energia e partículas até que se torne um elemento estável, que no seu caso é nitrogênio.
Isótopos de carbono
O carbono existe na natureza como uma mistura de vários isótopos, dos quais o mais abundante é o acima mencionado 12 6C ou carbono-12. E além do carbon-14 é o 13 6C com um nêutron adicional.
Pode atendê -lo: Circuitos atuais alternados: tipos, aplicações, exemplosIsso é comum na natureza, por exemplo de estanho, 10 isótopos estáveis são conhecidos. Por outro lado, um único isótopo é conhecido como berílio e sódio.
Cada isótopo, natural ou artificial, tem um ritmo de transformação diferente. Da mesma forma, é possível criar isótopos artificiais em laboratório, que geralmente são instáveis e decaem radioativamente dentro de um período muito breve de segundas frações, enquanto outros levam muito mais, tanto quanto a idade da terra ou mais.
Tabela de isótopos de carbono natural
| Isótopos de carbono | Número atômico Z | Número de massa a | % De abundância |
|---|---|---|---|
| 12 6 C | 6 | 12 | 98.89 |
| 13 6 C | 6 | 13 | 1.onze |
| 14 6 C | 6 | 14 | Traços |
Exemplos resolvidos
- Exemplo 1
Qual é a diferença entre 13 7 N e 14 7 N?
Responder
Ambos são átomos de nitrogênio, pois seu número atômico é 7. No entanto, um dos isótopos, que tem A = 13, tem um menos nêutron, enquanto o 14 7 N é o isótopo mais abundante.
- Exemplo 2
Quantos nêutrons existem no núcleo de um átomo de mercúrio, denotado como 201 80 Hg?
Responder
Desde A = 201 e Z = 80, e também sabe disso:
A = z + n
N = a - z = 201 - 80 = 121
E conclui -se que o Mercury Atom tem 121 nêutrons.
Referências
- Connor, n. O que é núcleo - estrutura do núcleo atômico - Definição. Recuperado de: periódico-rabo.org.
- Cavaleiro, r. 2017. Física para cientistas e engenharia: uma abordagem de estratégia. Pearson.
- Sears, Zemansky. 2016. Física da Universidade com Física Moderna. 14º. Ed. Volume 2.
- Tiptens, p. 2011. Física: conceitos e aplicações. 7ª edição. McGraw Hill.
- Wikipedia. Número de massa. Recuperado de: em.Wikipedia.org.
- « Nitrato de magnésio (mg (no3) 2) Estrutura, propriedades, usos
- Coplanares Points equação, exemplo e exercícios resolvidos »

