Nitrato de magnésio (mg (no3) 2) Estrutura, propriedades, usos

- 1563
- 281
- Terrell Stokes
Ele Nitrato de Magnésio É um sólido inorgânico cuja fórmula química é mg (não3)2. É um composto iônico formado pela união de um cátion de magnésio mag2+ e dois ânions de nitrato não3-.
O mg (não3)2 É um sólido branco cristalino. É muito higroscópico, ou seja, absorve a água do ambiente facilmente. Ao permanecer em contato com o ar do meio ambiente, ele tende a formar seu hexa -hidrato mg (não3)2 •6h2QUALQUER.
 Nitrato de magnésio mg (não3)2 pulverizado. Ondřej Mangl [Domínio Público]. Fonte: Wikimedia Commons.
Nitrato de magnésio mg (não3)2 pulverizado. Ondřej Mangl [Domínio Público]. Fonte: Wikimedia Commons. Hexa -hidrato de nitrato de mag (não3)2 •6h2O tem em sua estrutura cristalina 6 moléculas de água h2Ou para cada molécula de mg (não3)2. O nitrato de magnésio é encontrado em cavernas e minas na forma de mineral de nitromagnesita.
O mg (não3)2 É obtido comercialmente reagindo o metal mg com ácido nítrico hno3.
Possui usos muito variados, como a agricultura como fertilizante, porque fornece elementos nutritivos para plantas como nitrogênio (N) e magnésio (mg).
É usado na indústria de fogos de artifício ou pirotecnia e também na obtenção de ácido nítrico concentrado. É usado em análise química, em experimentos de física e estudos médicos e científicos.
[TOC]
Estrutura
O nitrato de anghydro de magnésio é formado por um cátion de magnésio mg2+ e dois ânions de nitrato não3-.
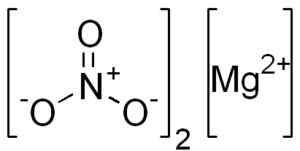 Estrutura mg (não3)2. Edgar181 [domínio público]. Fonte: Wikimedia Commons.
Estrutura mg (não3)2. Edgar181 [domínio público]. Fonte: Wikimedia Commons. O íon magnésio mg2+ Tem configuração eletrônica: 1s2, 2s2 2 p6, 3s0, Bem, os dois elétrons da camada mais externa (3s) produziram. Esta conformação é muito estável.
O íon não3- Tem uma estrutura plana e simétrica.
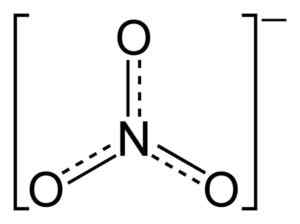 Estrutura de íons de nitrato plano não3-. As linhas pontilhadas indicam a distribuição equitativa dos elétrons entre as três ligações N-O. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons.
Estrutura de íons de nitrato plano não3-. As linhas pontilhadas indicam a distribuição equitativa dos elétrons entre as três ligações N-O. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons. Na estrutura de não3- A carga negativa é continuamente distribuída entre os três átomos de oxigênio.
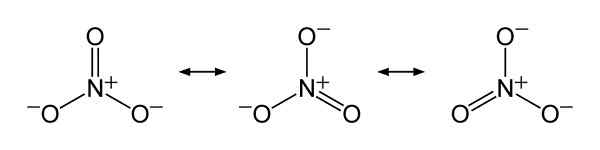 Estruturas de ressonância de íons de nitrato não3-, Para explicar a distribuição equitativa da carga negativa entre os três átomos de oxigênio. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons.
Estruturas de ressonância de íons de nitrato não3-, Para explicar a distribuição equitativa da carga negativa entre os três átomos de oxigênio. Benjah-BMM27 [domínio público]. Fonte: Wikimedia Commons. Nomenclatura
-Nitrato de anghydro de magnésio: mg (não3)2
Pode atendê -lo: água destilada-Nitrato de magnésio di -hidratado: mg (não3)2 •2h2QUALQUER
-Nitrato de magnésio hexa -hidrato: mg (não3)2 •6h2QUALQUER
-Dinitrato de magnésio
Propriedades
Estado físico
-Mg (não3)2 Anidro: Cristais brancos sólidos e cúbicos.
-Mg (não3)2 Di -hydrado: sólido branco cristalino.
-Mg (não3)2 Cristais hexahided: Solid Solid Solid e Monoclinic
Peso molecular
-Mg (não3)2 ANYDROUS: 148,31 g/mol
-Mg (não3)2 Hexa -hidrato: 256,41 g/mol
Ponto de fusão
-Mg (não3)2 Hexa -hidrato: 88,9 ºC
Ponto de ebulição
-Mg (não3)2 Hexa -hidrato: Não ferva, decomponha a 330 ° C
Densidade
-Mg (não3)2 Anidro: 2,32 g/cm3
-Mg (não3)2 DIYDRARD: 1.456 g/cm3
-Mg (não3)2 Hexa -hidrato: 1.464 g/cm3
Solubilidade
O nitrato de angênio de aninhdro é muito solúvel em água: 62,1 g/100 ml a 0 ºC; 69,5 g/100 ml a 20 ºC. Também é muito higroscópico, estar em contato com o ar rapidamente forma hexa -hidrato.
O mg (não3)2 Dihydrado também é muito solúvel em água e etanol. É higroscópico.
O mg (não3)2 Hexa -hidrato também é muito solúvel em água. É moderadamente solúvel em etanol. É o mais estável dos três em contato com o ar, ou seja, dos três é o que menos absorve a água do meio ambiente.
Efeito de aquecimento
Enviando uma solução aquosa de mg (não3)2 Para evaporação da água, o sal que cristaliza é hexa -hidratado: mg (não3)2 •6h2QUALQUER. Hexa -hidrato significa que na sólida molécula de mg (não3)2 Está ligado a 6 moléculas de água.
Há também Mg di -hidrato (não3)2 •2h2Ou, no qual o MG (não3)2 sólido é conectado a 2 moléculas de água.
Aquecimento de mg hexa -hidrato (não3)2 •6h2Ou o sal de anhydra não é obtido, porque o nitrato de magnésio tem uma alta afinidade pela água.
Por esse motivo, aquecendo -o acima do seu ponto de fusão, um sal misto de nitrato e hidróxido de magnésio mg (não3)2 •4mg (oh)2.
Este sal misto, quando atinge 400 ºC, decompõe -se ao óxido de magnésio e destaca os gases de óxidos de nitrogênio.
Pode servir a você: Hipoclorito de cálcio (CA (CLO) 2)Obtenção
Pode ser preparado reagindo carbonato de magnésio MGCO3 Com ácido nítrico hno3, Desistindo de carbono dióxido Co2:
MGCO3 + 2 hno3 → mg (não3)2 + Co2↑ + h2QUALQUER
Também pode ser obtido com hidróxido de magnésio MG (OH)2 e ácido nítrico:
Mg (oh)2 + 2 hno3 → mg (não3)2 + 2 h2QUALQUER
Obtido comercialmente de várias maneiras:
1- REACTING MAGNESIO MG com ácido nítrico HNO3.
2- por reação de óxido de magnésio de MGO com hno de ácido nítrico3.
3- Juntando-se ao hidróxido de magnésio MG (OH)2 e nitrato de amônio NH4NÃO3, formando nitrato de magnésio com destacamento de amônia NH3.
Localização na natureza
O mg (não3)2 O hexa -hidrato é naturalmente encontrado em minas e cavernas ou cavernas na forma de mineral de nitromagnesita.
Este mineral está presente quando o Guano entra em contato com rochas ricas em magnésio. O Guano é o material resultante da excremento de aves e focas do mar em ambientes muito secos.
Formulários
O mg (não3)2 O hexa -hidrato é usado nas indústrias de cerâmica, química e agricultura.
Este composto é um fertilizante porque fornece nitrogênio (n), que é um dos três elementos básicos exigidos pelas plantas e magnésio (mg), que também é um componente secundário também importante para estes.
Dessa maneira, é usado com outros ingredientes em estufas e na cultura hidropônica. O último é cultivar plantas em uma solução aquosa com sais de fertilizantes em vez de solo.
 Cultura hidropônica. Você pode ver os canais através dos quais a solução aquosa com sais de fertilizantes, como o nitrato de magnésio MG circula (não3)2. Autor: Marsraw. Fonte: Pixabay.
Cultura hidropônica. Você pode ver os canais através dos quais a solução aquosa com sais de fertilizantes, como o nitrato de magnésio MG circula (não3)2. Autor: Marsraw. Fonte: Pixabay. Também é usado como catalisador na obtenção de compostos petroquímicos. Permite que você ajuste a viscosidade em determinados processos. O nitrato de anghydro de magnésio é usado na pirotecnia, isto é, para fabricação de fogos de artifício.
 Os fogos de artifício contêm nitrato de magnésio mg (não3)2. Autor: Grátis Free. Fonte: Pixabay.
Os fogos de artifício contêm nitrato de magnésio mg (não3)2. Autor: Grátis Free. Fonte: Pixabay. O nitrato de anghydro de magnésio é um agente desidratante. É usado, por exemplo, para obter ácido nítrico concentrado, pois elimina a água e concentra os vapores de ácido até 90-95% dos HNOs3.
Pode atendê -lo: regra diagonal Ácido nítrico concentrado. O uploader original era FABEXPOSIVE na Wikipedia italiana. [GFDL (http: // www.gnu.Org/copyleft/fdl.html)]. Fonte: Wikimedia Commons.
Ácido nítrico concentrado. O uploader original era FABEXPOSIVE na Wikipedia italiana. [GFDL (http: // www.gnu.Org/copyleft/fdl.html)]. Fonte: Wikimedia Commons. Também é usado para cobrir o nitrato de amônio e permitir a formação de pérolas desse material comprimido.
Possui utilidade em formulação de tinta, toner (pó preto usado em sistemas fotocopiados) e produtos para colorir. Serve como padrão de magnésio na química analítica.
Sal de nitrato de magnésio e cerio mg (não3)2 •Carcaça3)3 É interessante para os experimentos de física a baixas temperaturas, pois é usado como refrigerante em experimentos de sumagnetização adiabática (sem transferência de calor).
Este sal de magnésio e cerio tem sido usado para estabelecer níveis de temperaturas extremamente baixas da escala Kelvin (perto de zero absoluto).
Em estudos recentes
Vários pesquisadores usaram MG (não3)2 Em composições com polímeros sintéticos e naturais para aumentar a condutividade em baterias de magnésio.
Também foi investigado na construção de supercaugadas para armazenamento de energia de alta potência.
Em estudos de doenças
O nitrato de magnésio foi administrado a ratos de laboratório com hipertensão arterial (alta pressão) e verificou -se que a pressão arterial diminui e atenua ou atenua os efeitos das complicações desta doença.
Também demonstrou efeitos protetores contra distúrbios neurológicos (desordem nos neurônios) e contra a morte em ratos durante os processos de cactoning da artéria carótida.
Referências
- Qian, m. et al. (2018). Carbonos porosos de poucas camadas extrainários de alta capacitância da combustão de Pechini de gel de nitrato de magnésio. Interfaces de Appl Mater 2018, 10 (1): 381-388. NCBI se recuperou.Nlm.NIH.Gov.
- Manjuladevi, r. et al. (2018). Um estudo sobre eletrólito de polímero de mistura baseado em poli. Ionics (2018) 24: 3493. Link recuperado.Springer.com.
- Kiruthika, s. et al. (2019). Eletrólito de biopolímero ecológico, pectina com sal de nitrato de magnésio, para aplicação em dispositivos electocímicos. J Solid State Electochem (2019) 23: 2181. Link recuperado.Springer.com.
- Vilskerts r. et al. (2014). O nitrato de magnésio atenua o aumento da pressão arterial em ratos SHR. Magnes Res 2014, 27 (1): 16-24. NCBI se recuperou.Nlm.NIH.Gov.
- Kuzenkov v.S. e Krushinskii a.eu. (2014). Efeito protetor do nitrato de magnésio contra distúrbios neurológicos provocados por isquemia cerebral em ratos. Bull Exp Biol Med 2014, 157 (6): 721-3. NCBI se recuperou.Nlm.NIH.Gov.
- ROPP, r.C. (2013). Grupo 15 (N, P, AS, SB e BI) Compostos da Terra Alcalina. Nitrato de Magnésio. Na enciclopédia dos compostos da Terra Alcalina. Recuperado de cientedirect.com.
- Kirk-Othmer (1994). Enciclopédia de tecnologia química. Volume 1. Quarta edição. John Wiley & Sons.
- OU.S. Biblioteca Nacional de Medicina. (2019). Nitrato de Magnésio. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov.
- « Conceito e características do sistema técnico, elementos, exemplos
- Número de massa do que consiste e como obtê -lo (com exemplos) »

