Estrutura de nitrito de sódio (NANO2), propriedades, usos, riscos

- 4021
- 371
- Tim Mann
Ele nitrito de sódio É um sólido inorgânico cristalino formado por um íon de sódio+ E um íon nitrito não2-. Sua fórmula química é nano2. É um sólido cristalino branco que tende a absorver a água do ambiente, ou seja, é higroscópico.
Na presença de ar oxida lentamente o nitrato de nitrato3. Possui propriedades oxidantes (outros compostos oxidados) e também redutor (é oxidado por outros compostos).
 Nano de nano de sódio2. Aleksander Sobolewski via Wikimedia Commons [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons.
Nano de nano de sódio2. Aleksander Sobolewski via Wikimedia Commons [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons. Está presente no organismo do ser humano naturalmente e é usado como conservante de carnes curadas e peixes defumados, pois evita o crescimento de microorganismos nocivos.
Tem um uso importante no tratamento de urgência do envenenamento por cianeto, à medida que o efeito tóxico e letal do referido composto diminui. No entanto, deve ser administrado com grande cautela e não funciona em todos os casos.
Verificou -se que poderia impedir os olhos infecções causadas pela contaminação das lentes de contato por microorganismos. Alguns estudos indicam que seu consumo com alimentos pode causar câncer, mas estima -se que isso possa ser evitado por comer vitamina C com esses alimentos.
[TOC]
Estrutura
O nitrito de sódio é formado pelo cátion de sódio+ E o ânion nitrito2-.
No ânion nitrito não2- O nitrogênio tem uma valência de +3 e oxigênio de -2, por esse motivo o ânion tem uma única carga negativa global.
Ânion nitrito no2- Possui uma estrutura angular, ou seja, as ligações de nitrogênio (n) com átomos de oxigênio (O) formam um ângulo.
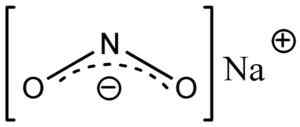 Estrutura de nano de nano sódio2, onde você pode ver a forma angular do ânion de nitrito não2-. Eschenmoser [domínio público]. Fonte: Wikimedia Commons.
Estrutura de nano de nano sódio2, onde você pode ver a forma angular do ânion de nitrito não2-. Eschenmoser [domínio público]. Fonte: Wikimedia Commons. Nomenclatura
- Nitrito de sódio
- Nitrito de sódio
- Sal de sódio com ácido nitroso.
Propriedades
Estado físico
Sólido cristalino branco amarelado. Cristais ortorrômbicos.
Peso molecular
68.995 g/mol
Ponto de fusão
271 ºC
Ponto de ebulição
Não ferva. Se decompõe acima de 320 ºC
Pode servir a você: hidreto de magnésio: estrutura, propriedades e usosDensidade
2,17 g/cm3 A 20 ºC
Solubilidade
Solúvel em água: 84,8 g/100 g de água a 25 ºC. Ligeiramente solúvel em etanol. Moderadamente solúvel em metanol. Dificilmente solúvel em dietyl éter.
ph
Suas soluções aquosas são alcalinas, pH aproximadamente 9. Isso ocorre porque o ácido nitroso é um ácido fraco que tende a não se dissociar, então o íon não2- Tente tomar um próton h+ Água para formar hno2, o que leva à formação de íons OH- Eles produzem alcalinidade.
NÃO2- + H2O → hno2 + Oh-
Outras propriedades
O nano de nano nitrito2 Na presença de ar oxida lentamente o nitrato de nitrato3. É um sólido higroscópico, pois absorve a água do meio ambiente.
Possui propriedades oxidantes (pode oxidar outros compostos) e também redutores (pode ser oxidado por outros compostos).
Se você entrar em contato com materiais como madeira, papel ou têxteis, poderá fazê -los entrar em combustão perigosamente.
Com os ácidos, ocorre sua decomposição, gerando uma mistura de gases tóxicos de óxidos de nitrogênio (nãox).
Obtenção
Pode ser obtido por aquecimento de nano de sódio nitrato3 Com chumbo pb:
Irmão mais velho3 + PB → Nano2 + PBO
Presença no organismo
O ânion de nitrito está naturalmente presente no sangue e nos tecidos, pois é formado como conseqüência da oxidação do não -.
Formulários
Na indústria de alimentos
É usado para Adobar Carnes, pois atua como um agente de cor e retenção de sabor e, como conservante, pois controla o crescimento de microorganismos, evitando em particular o desenvolvimento do desenvolvimento do Clostridium botulinum Causando doença do botulismo.
O nitrito de sódio em carnes reage com a hemoglobina de glóbulos vermelhos ou glóbulos vermelhos deste alimento. Também é usado em peixe defumado curado.
 Peixe defumado. Autor: Reinhard Thrainer. Fonte: Pixabay.
Peixe defumado. Autor: Reinhard Thrainer. Fonte: Pixabay. Como tratamento de emergência em envenenamento por cianeto
O nitrito de sódio é usado para o tratamento de envenenamento agudo de cianeto. É um antídoto para esse problema sério.
Pode atendê -lo: acetonitrila (C2H3N)Sua ação se deve ao fato de favorecer a formação de metaglobina (um tipo de hemoglobina) no sangue, que captura íons cianeto e não os libera e, assim, os impede de serem liberados em células, tornando -os menos tóxicos.
No caso de envenenamento por cianeto, o nitrito de sódio é aplicado por via intravenosa, levando cerca de 12 minutos para gerar metaglobina. Apesar desse atraso, ele também oferece proteção para seu efeito vasodilatador.
 Tratamento intravenoso. Michaelberry na Wikipedia inglesa [CC por 3.0 (https: // CreativeCommons.Org/licenças/por/3.0)]. Fonte: Wikimedia Commons.
Tratamento intravenoso. Michaelberry na Wikipedia inglesa [CC por 3.0 (https: // CreativeCommons.Org/licenças/por/3.0)]. Fonte: Wikimedia Commons. Para a dilatação de vasos sanguíneos
Serve para tratar a hipertensão arterial pulmonar porque age atrasando os vasos sanguíneos, reduzindo a pressão arterial. Estima -se que esse efeito seja devido ao fato de ser transformado em óxido nítrico, que não age relaxando os músculos macios.
No entanto, as causas de sua eficácia ainda estão em estudo.
Contra alguns parasitas
Certos pesquisadores descobriram que o nitrito de sódio inibe o crescimento e a multiplicação do parasita intestinal Blastocystis hominis Mesmo que isso seja resistente a outros medicamentos.
Verificou -se que o nano2 Gera a morte deste parasita por apoptose, que é um tipo de suicídio da célula do parasita. O nitrito de sódio faz com que as células intestinais não produzam não, o que parece ser importante nesse processo.
Para evitar danos aos órgãos
Segundo alguns estudos, o nitrito é um poderoso inibidor de danos cardíacos e fígado nos processos de isquemia (diminuição da irrigação sanguínea em uma parte do corpo). Acredita -se que isso seja porque é uma reserva biológica de não.
Concluiu -se que pode ser usado para evitar danos aos órgãos após restaurar o fluxo sanguíneo que foi interrompido por um ataque cardíaco, intervenção cirúrgica abdominal de alto risco ou transplante de algum órgão.
Para evitar infecções para o uso de lentes de contato
Verificou -se que o nano2 impede a formação de filmes patogênicos de microorganismos Staphylococcus aureus e Pseudomonas aeruginosa Sobre lentes de contato.
Pode atendê -lo: redução (química) As lentes de contato podem ser contaminadas com bactérias ou fungos. Entre em contato com a fotografia de lente em 7 de janeiro de 2006. Fonte: Fotografia por BPW. Fonte: Wikimedia Commons.
As lentes de contato podem ser contaminadas com bactérias ou fungos. Entre em contato com a fotografia de lente em 7 de janeiro de 2006. Fonte: Fotografia por BPW. Fonte: Wikimedia Commons. Em vários usos
O nitrito de sódio é usado para fabricar colorir, medicamentos e vários compostos orgânicos.
Também serve como inibidor de corrosão em várias gorduras.
Riscos ou inconvenientes
Um dos problemas do uso de nitrito de sódio para envenenamentos por cianeto é que ele causa distúrbios cardiovasculares graves em crianças.
Não é recomendado para vítimas de incêndio onde ocorre a exposição simultânea de cianeto e monóxido de carbono (CO) (CO). CO reduz a capacidade do sangue de transportar oxigênio, de modo que o governo nano2 agravaria a condição de pouco oxigênio no sangue do paciente.
O nitrito de sódio inalado é irritante e tóxico, pode danificar o sistema cardiovascular e o sistema nervoso central. Além disso, ele é prejudicial ao meio ambiente.
O nitrito de sódio ingerido com comida pode ser prejudicial. O nitrito, ao alcançar o estômago, reage com certos compostos que formam nitrosaminas, o que pode produzir câncer.
Essas reações podem ser evitadas na presença de vitamina C.
De acordo com certas fontes consultadas, o risco de consumir nitritos com carnes ou peixes curados é mínimo porque o nitrito está naturalmente presente na saliva.
Fontes indicam que esse risco também é mínimo em comparação com os grandes benefícios de consumir alimentos livres de microorganismos nocivos.
Referências
- Bhattacharya, r. e flora, S.J.S. (2015). Toxicidade de cianeto e seu tratamento. No Manual de Toxicologia de Agentes de Guerra Química (segunda edição). Recuperado de cientedirect.com.
- OU.S. Biblioteca Nacional de Medicina. (2019). Nitrito de sódio. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov.
- Kim, d.J. et al. (2017). A eficácia do antibiofilme do óxido nítrico na lente de contato suave. BMC Ophthalmol 17, 206 (2017). Recuperado de Bmcophthalmol.BiomedCentral.com.
- Ramis-Ramos, g. (2003). Antioxidantes. Antioxidantes sintéticos. Na Enciclopédia de Ciências Alimentares e Nutrição (Segunda Edição). Recuperado de cientedirect.
- Barozzi Seabra, A. e durán, n. (2017). Doadores de óxido nítrico para tratar doenças negligenciadas. Em doadores de óxido nítrico. Recuperado de cientedirect.com.
- Duranski, m.R. et al. (2005). Efeitos citoprotetores de nitrito durante a isquemia-reperfusão in vivo do coração e fígado. J Clin Invest 2005; 115 (5): 1232-1240. NCBI se recuperou.Nlm.NIH.Gov.
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.

