Estrutura, propriedades e usos de nitrito de potássio (KNO2)

- 1928
- 104
- Dennis Heidenreich
Ele Nitrito de potássio É um sal inorgânico cuja fórmula química é como2, que é quimicamente e farmacologicamente relacionado ao nitrato de potássio3. Sua aparência física consiste em cristais brancos amarelados, altamente higroscópicos e, portanto, delicados; isto é, eles se dissolvem rapidamente em ambientes úmidos.
Sua fórmula indica que a proporção de íons k+ e não2- É 1: 1 e permanecem unidos por forças eletrostáticas ou por links iônicos. Aparentemente, fontes naturais puras não foram encontradas para seus cristais, embora os ânions niter possam ser encontrados em solos, fertilizantes, plantas e animais.
 Cristais nitais de potássio. Fonte: LEIEM [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]
Cristais nitais de potássio. Fonte: LEIEM [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] A imagem superior mostra como os cristais de Kno parecem2, Com tons amarelos pronunciados. Se esses cristais forem deixados em contato com o ar, eles absorverão a umidade para se tornar uma solução aquosa; solução que gerou controvérsias em relação a se seu uso é ou não benéfico ou não.
Por outro lado, seus cristais, sob quantidades muito pequenas (200 ppm), são usados para salinizar carnes e garantir sua conservação contra a ação bacteriana. Além disso, o KNO2 Melhora a cor das carnes, tornando -as mais avermelhadas; No entanto, está sujeito a várias restrições para evitar os efeitos tóxicos desse sal no corpo.
[TOC]
Estrutura de nitrito de potássio
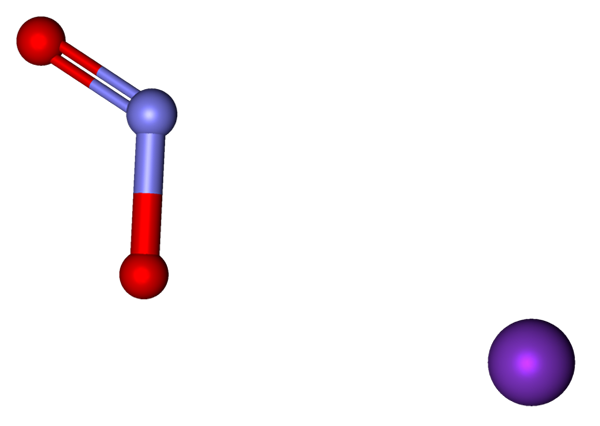 Íons que compõem o kno2 representados com um modelo de esferas e bares. Fonte: Marinavladivok [CC0].
Íons que compõem o kno2 representados com um modelo de esferas e bares. Fonte: Marinavladivok [CC0]. Os íons presentes no nitrito de potássio são mostrados acima. O cátion k+ corresponde à esfera roxa, enquanto o ânion não2- É representado pelas esferas azuladas e vermelhas.
O ânion não2- É mostrado com uma ligação dupla e um simples [o = n-o]-; Mas, na realidade, ambos os links são os mesmos que resultado da ressonância da carga negativa entre eles.
Os íons k+ e não2- Eles se atraem no espaço para organizar um padrão estrutural com a menor energia; É aqui que as repulsões entre as cargas iguais são mínimas. E assim os cristais de kno acreditam2, cuja célula unitária é suscetível a mudanças de temperatura, quais transições de fase.
Pode servir você: Stanislao CannizzaroPor exemplo, a baixas temperaturas (menos de 25 ° C) os cristais de kno2 Adote um sistema monoclínico (Fase I). Quando a temperatura excede 25 ° C, ocorre uma transição de fase monoclínica romboébica (Fase II). Finalmente, acima de 40 ° C os cristais de kno2 mudança para ser cúbica (Fase III).
Além disso, o KNO2 pode exibir outras fases cristalinas (fases IV, V e VI) sob altas pressões. Com isso, K íons+ e não2- Eles acabam se movendo e ordenados de maneiras diferentes em seus cristais puros.
Propriedades
Massa molecular
85.1038 g/mol.
Densidade
1.9150 g/ml.
Ponto de fusão
440,02 ° C (mas começa a quebrar de 350 ° C, emitindo vapores tóxicos).
Ponto de ebulição
537 ° C (explosão).
Solubilidade em água
312 g/ 100 g de água a 25 ° C.
Delicescência
Sua solubilidade na água é tal que é higroscópica; Tanto, isso exibe delioscência, absorvendo umidade suficiente para se dissolver. Essa afinidade para a água pode ser devido à estabilidade energética que os íons k ganham+ Quando hidratante, bem como uma baixa entalpia de rede cristalina para os cristais de kno2.
Os cristais podem absorver água sem se dissolver para se tornar um hidrato2· H2QUALQUER. Em hidratar, a molécula de água está acompanhando os íons, que modifica a estrutura cristalina.
Este hidrato (ou vários deles) pode ser formado abaixo de -9 ° C; A uma temperatura mais alta, a água se dissolve e hidrata os íons, deformando o vidro.
Solubilidade em outros solventes
Ligeiramente solúvel em álcoois quentes e muito solúvel em amônia.
ph
6-9. Suas soluções aquosas são, portanto, alcalinas, uma vez que o ânion não2- Pode hidrolizar.
Nomenclatura
Para Kno2 Também pode ser nomeado de outras maneiras. 'Nitrito de potássio' corresponde ao nome deste sal de acordo com a nomenclatura da ação; 'Nitrito de potássio', de acordo com a nomenclatura sistemática, na qual a única valência do potássio, +1 é destacada; e Dioxonitrato (III) de potássio, de acordo com a nomenclatura sistemática.
Pode atendê -lo: dibenzalacetona: propriedades, mecanismo de reação, usos, riscosDioxonitrato de potássio (iii), destaca a valência +3 do átomo de nitrogênio. Até o nome mais recomendado pelo IUPAC para o KNO2, 'Nitrito de potássio' continua a ser o mais confortável e o mais fácil de lembrar.
Obtenção
A maneira mais direta de sintetizá -lo, mas com menor desempenho, é através da decomposição térmica de nitrato de potássio ou salgadinho a 400 ° C ou mais:
2kno3 => KNO2 + QUALQUER2
No entanto, parte do KNO2 acaba se decompor pelo calor, além de outros produtos.
Outro método para prepará -lo ou sintetizá -lo com maior desempenho é reduzir o knO3 Na presença de chumbo, cobre ou zinco. A equação para esta reação é a seguinte:
Kno3 + Pb => kno2 + PBO
O potássio e o nitrato de chumbo são misturados estequiometricamente em uma panela de ferro, onde se fundem com agitação e aquecimento constantes por meia hora. O óxido de chumbo (II) é amarelo e a massa resultante é quente e tratada com água fervente. Então a mistura quente filtros.
O filtro a quente borbulha com dióxido de carbono por cinco minutos, que precipitará carbonato de chumbo, PBCO3, insolúvel. Dessa forma, o chumbo está terminado. O ácido nítrico diluído à filtragem é adicionado até que o pH seja neutro, é permitido esfriar e, finalmente, a água evapora para que os cristais de KNO sejam formados2.
Formulários
Aditivo e reagente
O nitrito de potássio é usado como um aditivo para curar carnes vermelhas, mantendo seu sabor e mais cor de tempo durante o armazenamento, enquanto atrasa a ação bacteriana e certas toxinas, como a botulínica. Portanto, exibe ação antibacteriana.
O kno2 Ele não oxida, o que reage com a mioglobina da carne e, consequentemente, acaba modificando sua cor vermelha natural. Então, quando a carne é cozida, adquire sua característica cor rosa forte.
Pode atendê -lo: 20 exemplos de sublimação química e característicasNo entanto, sob condições sem especificar o KNO2 reage com proteínas de carne para dar origem à nitrosamina, que pode se tornar carcinogênica.
Por outro lado, o kno2 (embora de preferência nano2) É um reagente analítico que pode ser usado na síntese de corantes azóicos (a reação do ácido nitroso com aminas aromáticas) e na análise de aminoácidos.
Antídoto
Embora tenha seus efeitos negativos, KNO2 Atua como um antídoto em pacientes envenenados com cianetos e sulfeto de hidrogênio. Seu mecanismo é oxidar os centros de fé2+ para a fé3+ Dos grupos que temos das hemoglobinas, produzindo metaglobina, que então reage com os ânions CN- e hs-.
Médicos
No suco gástrico do estômago, o ânion não2- É reduzido a não, que é conhecido por ter ação vasodilatadora, aumentando o fluxo sanguíneo. Em outras regiões do corpo onde o pH não é ácido suficiente, algumas enzimas, como a Xanthina oxidortada, são responsáveis por reduzir o não -2-.
KNO tem sido usado2 tratar doenças e doenças como angina de tórax e epilepsia (com efeitos colaterais muito negativos).
Referências
- Wikipedia. (2019). Nitrito de potássio. Recuperado de: em.Wikipedia.org
- Prebchem. (2016). Preparação Nitrito de potássio. Recuperado de: Prepchem.com
- Mark Gilchrist, Angela C. Costa, Nigel Benjamin. (2011). Nitrato inorgânico e nitrito e controle da pressão arterial, pesquisa cardiovascular, volume 89, edição 3, 15 de fevereiro de 2011, páginas 492-498, doi.org/10.1093/CVR/CVQ309
- PubChem. (2019). Nitrito de potássio. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Formulação química. (2018). Nitrito de potássio. Recuperado de: formulação Quimica.com
- Centro Nacional de Avançar Ciências Translacionais. (2011). Nitrito de potássio. Recuperado de: drogas.NCATS.Io
- Richard J. Eley, Paul B. Addis e Joseph J. Wartheen. (1992). Nitrito em carne. Universidade de Minnesota.
- N. R. Rao, b. Prakash e M. Natarajan. (1975). Transformações da estrutura cristalina em nitritos, nitratos e carbonatos inorgânicos. Departamento de Química, Instituto Indiano de Tecnologia, Kanpur, Índia.
- « Características políticas de fala, tipos, questões e exemplos
- Poluição de lixo Causas, consequências e exemplos »

