Nitrato de cálcio (CA (NO3) 2)

- 2083
- 579
- Ernesto Bruen
Ele nitrato de cálcio É um sal inorgânico terciário cuja fórmula química é CA (não3)2. De sua fórmula, sabe -se que seu sólido é composto de íons ca2+ e não3- Em uma proporção 1: 2. Portanto, é um composto de natureza puramente iônica.
Uma de suas propriedades é o seu caráter oxidante, seguindo o ânion nitrato. Não é combustível, isto é, não queima em altas temperaturas. Sendo não -combinado, representa um sólido seguro para manipulá -lo sem grandes cuidados; No entanto, pode acelerar a ignição de materiais combustíveis.
 Nitrato de cálcio sólido. Fonte: Ondřej Mangl [Domínio Público], da Wikimedia Commons
Nitrato de cálcio sólido. Fonte: Ondřej Mangl [Domínio Público], da Wikimedia Commons Sua aparência consiste em sólido granular, que apresenta uma cor branca ou cinza clara (imagem superior). Pode ser anidro ou tetra -hidrato, CA (não3)2· 4h2QUALQUER. É muito solúvel em água, metanol e acetona.
O nitrato de cálcio tem sido amplamente utilizado como fertilizante, pois se move facilmente em solo úmido e é rapidamente absorvido pelas raízes das plantas. Fornece dois elementos importantes para a nutrição e crescimento de plantas: nitrogênio e cálcio.
O nitrogênio é um dos três elementos essenciais para o desenvolvimento de plantas (N, P e K), é essencial na síntese de proteínas. Enquanto isso, o cálcio é necessário para manter a estrutura da parede celular das plantas. Por esse motivo o CA (não3)2 Jardins está muito destinado.
Por outro lado, esse sal tem ações tóxicas, especialmente pelo contato direto com a pele e os olhos, além de inalar seu pó. Além disso, pode ser quebrado por aquecimento.
Estrutura de nitrato de cálcio
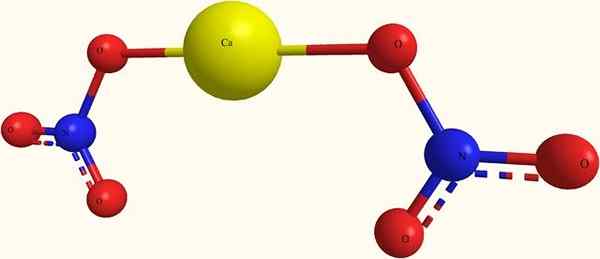 Íons nitratos de cálcio. Fonte: я.Hardnox em ru.Wikipedia [domínio público], da Wikimedia Commons
Íons nitratos de cálcio. Fonte: я.Hardnox em ru.Wikipedia [domínio público], da Wikimedia Commons Na imagem superior, a estrutura do CA (não3)2 Em um modelo de esferas e bares. Aqui, no entanto, existe um defeito: a existência de ligações covalentes Ca-O é assumida, o que contradiz seu caráter iônico. Esclarecendo isso, as interações são realmente do tipo eletrostático.
O cátion ca2+ É cercado por dois ânions não3- De acordo com suas proporções no vidro. O nitrogênio na forma de nitrato na estrutura cristalina predomina.
Os íons são agrupados de tal maneira que estabelecem uma configuração cuja expressão mínima é a célula unitária; que, para o sal anidro, é cúbico. Isto é, de cubos contendo a proporção 1: 2 para esses íons, todo o vidro é reproduzido.
Pode atendê -lo: lata: estrutura, propriedades, obtenção, usosPor outro lado, o sal de tetra -hidrato, CA (não3)2· 4h2Ou, possui quatro moléculas de água para cada conjunto3- AC2+ NÃO3-. Isso modifica a estrutura cristalina, deformando -a em uma célula monoclínica unitária.
Portanto, os cristais para ambos os sais, anidros e tetra -hidratos, sejam diferentes; Diferenças que podem ser determinadas em suas propriedades físicas, por exemplo, pontos de fusão.
Propriedades físicas e químicas
Nomes químicos
-Nitrato de cálcio
-Dinitrato de cálcio
-Nitrocalcita
-Salitre norueguês e Limesaltpetro.
Fórmula molecular
Bico; esquichar3)2 ou pode2QUALQUER6
Peso molecular
Anhidro 164.088 g/mol e tetra -hidrato 236,15 g/mol. Observe o efeito da água no peso molecular e não pode ser desprezado ao fazer seus respectivos pesados.
Aspecto físico
Grânulos cinza sólidos ou claros. Cristais brancos cúbicos ou grânulos deliciosos; isto é, eles absorvem a umidade a ponto de dissolver o produto de sua alta solubilidade.
Ponto de ebulição
A forma anidro se decompõe aquecendo a uma temperatura que impede a determinação de seu ponto de ebulição; Enquanto a forma de sal tetra -hidrato tem um ponto de ebulição de 132 ºC (270 ºF, 405 K).
Ponto de fusão
-Anhydra Form: 561 ºC a 760 mmHg (1042 ºF, 834 K).
-Formulário de tetra -hidrato: 42,7 ºC (109 ºF, 316 K).
Isso demonstra como as moléculas de água interferem nas interações eletrostáticas entre a CA2+ e não3- dentro dos cristais; E consequentemente, o sólido derrete a uma temperatura muito mais baixa.
Solubilidade em água
-Anhydra Form: 1212 g/L a 20 ºC.
-Formulário de tetra -hidrato: 1290 g/L a 20 ºC.
A água em cristais mal aumenta a solubilidade do sal.
Solubilidade em solventes orgânicos
-Em etanol, 51,42 g/100 g a 20 ºC.
-Em metanol, 134 g/100 g a 10 ºC.
-Na acetona, 168 g/100 g a 20 ºC.
Acidez (PKA)
6.0
Densidade
2,5 g/cm3 a 25 ºC (tetra -hidrato).
Decomposição
Quando o nitrato de cálcio é aquecido à incandescência, ele se decompõe em óxido de cálcio, óxido de nitrogênio e oxigênio.
Perfil reativo
É um agente fortemente oxidante, mas não é combustível. Acelera a ignição de materiais combustíveis. A divisão de nitrato de cálcio em partículas finas, facilita sua explosão quando o composto é exposto a fogo prolongado.
Pode servir a você: ligas não ferrosas: estrutura, propriedades, usos, exemplosMisturas com ésteres alquil se tornam explosivos, causando ésteres de nitrato de alquil. A combinação de nitrato de cálcio com fósforo, cloreto de estanho (II) ou outro agente redutor pode reagir explosivamente.
Formulários
Agricultura
É usado em culturas como fonte de nitrogênio e cálcio. O nitrato de cálcio é muito solúvel na água e facilmente absorvido pelas raízes das plantas. Além disso, não acidifica os solos porque seus íons não podem hidrolizar significativamente.
Sua mistura deve ser evitada com fertilizantes contendo fósforo ou sulfato, para evitar a formação de sais insolúveis. Após sua higroscopicidade, ele deve ser armazenado em um ambiente seco e fresco.
Seu uso tem uma vantagem sobre o uso de nitrato de amônio como fertilizante. Enquanto o último composto traz nitrogênio às plantas, interfere na absorção de cálcio, o que pode produzir uma deficiência de cálcio nas plantas.
O cálcio contribui para a manutenção da estrutura da parede celular da planta. Na presença de uma deficiência de cálcio, os tecidos na formação de plantas, como as pontas das raízes, as folhas jovens e as pontas dos surtos, geralmente mostram crescimento distorcido.
Diminuição do amônio
O nitrato de cálcio reduz o acúmulo de ácidos graxos voláteis e compostos fitotóxicos fenólicos que se acumulam pela decomposição de resíduos de culturas de soja.
Além disso, há uma tendência de nitrato de cálcio para reduzir a concentração de amônio no solo, o que aumenta a capacidade de amortecimento de hidrogênio.
Concreto
O nitrato de cálcio é usado para reduzir o tempo de configuração do concreto. Isso é produzido pela geração de hidróxido de cálcio, talvez por uma reação de deslocamento duplo.
Além disso, o nitrato de cálcio induz a geração de composto de hidróxido de ferro, cuja ação protetora do concreto reduz sua corrosão. Ou seja, o ferro presente pode reagir com os componentes básicos do concreto, como o próprio hidróxido de cálcio.
O nitrato de cálcio diminui o tempo de configuração, bem como a resistência do concreto, ao qual as cinzas vulcânicas foram adicionadas. Para estudar o efeito do agregado de nitrato de cálcio no concreto, aumentando as concentrações de nitrato de cálcio, entre 2% e 10%.
Pode servir a você: fração molar: como é calculado, exemplos, exercíciosFoi observada uma maior diminuição no tempo de ajuste, bem como um aumento na resistência ao concreto à medida que a concentração de nitrato de cálcio aumentou para 10%.
Esgoto ou tratamento de resíduos
O nitrato de cálcio é usado para reduzir maus cheiros de esgoto, diminuindo o sulfeto de hidrogênio. Além disso, a matéria orgânica que gera condições anaeróbicas que dificulta a sobrevivência de muitas espécies biológicas é consumida.
Preparação de compactação a frio
O nitrato de cálcio tetra -hidrato é um composto endotérmico, ou seja, ele tem a capacidade de absorver o calor do ambiente que o rodeia. Isso produz um resfriamento dos corpos que entram em contato com os recipientes que o contêm.
As compressas aumentam sua temperatura e para regenerá -las, é suficiente colocá -las em um freezer
Coagulação do látex
O nitrato de cálcio é usado na fase de coagulação do látex. Faz parte da solução de imersão e, quando entra em contato com a solução que o látex contém, quebra sua estabilização e causa sua coagulação.
Transferência de calor e armazenamento
A mistura binária de sais de nitratos fundidos, incluindo cálcio com outros nitratos, é usado em vez de óleo térmico em usinas de energia solar para transferência de calor e armazenamento.
Formas de aplicação
-O nitrato de cálcio misturado com o solo é aplicado a uma concentração de 1,59 kg por 30,48 m2, com irrigação adequada. O nitrato de cálcio é solubilizado na água, permitindo sua absorção pelas raízes da planta. Nas colheitas hidropônicas, ele se dissolve em água de cultivo.
-O nitrato de cálcio em forma de spray também é usado para pulverizar as folhas e as flores, sendo um tratamento eficaz na prevenção da podridão da flor de tomate, o ponto de cortiça e o buraco amargo da maçã.
-É adicionado à mistura de concreto (cimento, areia, pedras e água) uma quantidade de nitrato de cálcio e o efeito da adição tem nas propriedades específicas do concreto; como definir velocidade e resistência.
-O nitrato de cálcio é adicionado a uma concentração adequada para reduzir maus cheiros de esgoto ou resíduos, a um nível que os odores são toleráveis para as pessoas.
Referências
- Especificações de nitrato de cálcio. Recuperado de: Direct2Farmer.com
- Nitrato de cálcio. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov

