Método de balanceamento algébrico (com exemplos)

- 1214
- 311
- Melvin Mueller
Ele Método de equilíbrio algébrico É usado em química para corresponder ao número de átomos em ambos os lados de uma reação química. Uma reação química escrita corretamente, deve ter as fórmulas de todos os reagentes que participam do lado esquerdo e dos produtos, também com suas fórmulas, no lado direito.
No entanto, quando você tem uma reação, o número de átomos nas fórmulas dos reagentes é igual ao dos respectivos átomos nas fórmulas dos produtos, nem sempre nem sempre.
 figura 1. O método de equilíbrio algébrico é uma ferramenta simples para equilibrar equações químicas. Fonte: f. Zapata.
figura 1. O método de equilíbrio algébrico é uma ferramenta simples para equilibrar equações químicas. Fonte: f. Zapata. No entanto, a massa é preservada. Por exemplo, vamos ver a seguinte reação:
KCl3 → KCl + O2
Esta equação tem um composto chamado clorato de potássio, que é quebrado por aquecimento em cloreto de potássio e oxigênio a gás. Mas ao assistir com cuidado, notamos que na molécula de clínico existem 3 átomos de oxigênio, enquanto à direita há apenas uma molécula de oxigênio a gás com 2 átomos.
O que é feito é feito é multiplicar por um coeficiente numérico para o reagente da esquerda, para que o número de átomos de todos os elementos participantes seja o mesmo antes e depois da reação.
Mas ... qual é o valor deste coeficiente?
[TOC]
Maneiras de equilibrar equações
Na equação anterior, é fácil determinar os coeficientes apropriados por inspeção. Se multiplicarmos por 2 à esquerda, temos 2 átomos de K, 2 de Cl e 6 de O.
Portanto, à direita, multiplicamos o cloreto de potássio por 2 e o O2 por 3:
2 KCLO3 → 2kcl + 3o2
E agora podemos ver que a contabilidade está correta em ambos os lados da flecha e a reação foi equilibrada. Observe que outros valores numéricos também podem resultar em uma equação equilibrada, por exemplo:
Pode atendê -lo: ácido bórico: estrutura química, propriedades, preparação, usos4 KCLO3 → 4KCl + 6o2
No entanto, o conjunto de números mínimos inteiros iguais à quantidade de átomos de ambos os lados sempre deve ser procurada.
Os números que multiplicam cada fórmula são chamados coeficientes. É muito importante observar que os coeficientes podem ser atribuídos ao equilíbrio, mas os subscritos devem permanecer como aparecem em cada fórmula.
Nem os coeficientes podem ser inseridos no meio da fórmula de cada composto, pois isso a alteraria.
Equações simples, como exemplo, podem ser equilibradas por inspeção ou pontuação. Para aqueles que são um pouco mais complexos, há um método algébrico com uma série de etapas simples e operações aritméticas elementares detalhadas abaixo.
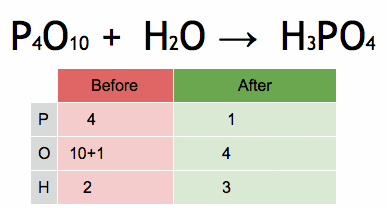 Figura 2. Animação que mostra o equilíbrio de uma equação química para obter ácido fosfórico. Fonte: Wikimedia Commons. Ephert/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0)
Figura 2. Animação que mostra o equilíbrio de uma equação química para obter ácido fosfórico. Fonte: Wikimedia Commons. Ephert/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0) Passos para equilibrar algebricamente uma equação química
Passo 1
-Atribuir a cada molécula um coeficiente arbitrário, simbolizado por uma letra. Letras A, B, C, D .. ., tão necessário o necessário.
Importante: Lembre -se de que apenas um coeficiente é usado pela molécula e nunca é intercalado no meio dele, ele sempre é colocado à esquerda.
Passo 2
-Faça uma lista de cada elemento participante.
etapa 3
-Coloque o coeficiente ou coeficientes atribuídos a cada composto à esquerda e corresponda aos da direita. Se houver subscritos, eles se multiplicam pelo coeficiente para encontrar o número total de átomos.
E se algum elemento for encontrado em mais de uma molécula, as quantidades de átomos presentes de cada lado serão adicionadas. Dessa forma, o equações parciais de cada elemento.
Passo 4
-Um valor numérico é atribuído a um dos coeficientes. Geralmente esse valor numérico é 1 e é atribuído à letra que aparece mais vezes. Isso alcança uma equação simples que serve como ponto de partida para encontrar os outros coeficientes.
Pode atendê -lo: fator de diluiçãoEtapa 5
-Determinar o valor do seguinte coeficiente por aritmética simples e substitua seu valor em outra equação, para aumentar um novo.
Etapa 6
-Repita a etapa anterior para substituir os valores e criar uma nova equação, até encontrar todos os coeficientes.
Etapa 7
-Substitua os valores assim determinados. Se esses valores forem inteiros, deve -se verificar se a equação foi equilibrada. Se eles não eram inteiros, é multiplicado pelo múltiplo comum mínimo dos denominadores e o saldo é verificado.
Em seguida, visualizaremos a aplicação dessas etapas na resolução de alguns exemplos.
Exemplos de equilíbrio resolvidos
Exemplo 1
Equilibre a seguinte reação, se necessário, através do método algébrico:
N2QUALQUER5 → n2QUALQUER4 + QUALQUER2
Solução
Observamos que a reação não é equilibrada, porque, embora existam 2 átomos de nitrogênio em ambos os lados, com oxigênio as quantidades à esquerda e a direita são diferentes.
Então devemos seguir as etapas descritas na seção anterior:
-Escrevemos a equação novamente e multiplicamos cada molécula por um coeficiente diferente. As letras minúsculas são escolhidas para que não sejam confundidas com os elementos:
A⋅n2QUALQUER5 → B⋅n2QUALQUER4 + C⋅O2
-Agora listamos cada elemento e combinamos as quantidades desse elemento à esquerda e direita. Estas são as equações parciais para cada elemento:
- A⋅n2 = B⋅n2
- A⋅o5 = B⋅O4 + C⋅O2
-Multiplicando o coeficiente e o subscrito, obtemos o número de átomos de nitrogênio. Da Equação 1, obtemos:
2a = 2b
-Da equação 2 tem 5 ª átomos de oxigênio à esquerda, enquanto à direita há 4b e 2 c:
5a = 4b + 2c
-Atribuímos o valor 1 ao coeficiente A, dessa maneira:
A = 1
Essa escolha é arbitrária, também pode ser escolhida primeiro b = 1.
-Esses valores são substituídos na Equação 2, para determinar o valor de C:
Pode atendê -lo: óxido cúprico (CuO)5 = 4 + 2c
2c = 5-4 = 1
C = ½
-Substituímos os coeficientes na equação original, o 1 não é necessário para escrevê -la explicitamente:
N2QUALQUER5 → n2QUALQUER4 + ½ o2
-Como é preferível que os coeficientes sejam inteiros, toda a equação é multiplicada pelo múltiplo comum mínimo dos denominadores, que são 2 e 1:
m.c.m. (1.2) = 2
Então, multiplicando a esquerda e a direita por 2, é obtido:
2n2QUALQUER5 → 2n2QUALQUER4 + QUALQUER2
E contamos o número de átomos de ambos os lados, para verificar o saldo:
- N À esquerda: 4
- Ou esquerda: 10
- N À direita: 4
- Ou à direita: 8 + 2 = 10
Exemplo 2
Equilibre a seguinte reação química:
Nahco3 → Na2Co3 + H2Ou + co2
Solução
Multiplamos cada molécula por um coeficiente diferente:
A⋅ nahco3 → B⋅na2Co3 + C⋅H2O + D⋅CO2
Então propomos a contabilidade de cada elemento à direita e à esquerda da flecha. Há um total de 4 elementos na reação: NA de sódio; Hidrogênio H; carro de carro e oxigênio ou, tudo deve ser contado:
- A⋅na = b⋅na2
- a⋅h = c⋅h2
- A⋅c = b⋅c + d⋅c
- A⋅o3 = B⋅O3+C⋅O+D⋅O2
De acordo com cada saldo, são obtidas as seguintes equações:
1) a = 2b
2) a = 2c
3) a = b + d
4) a = 3b + c + 2d
O coeficiente mais repetido é para, Portanto, atribuímos o valor 1:
A = 1
Então:
1) a = 2b ⇒ b = ½
2) a = 2c ⇒ c = ½
3) a = b + d ⇒ d = a - b = 1 - ½ = ½
Substituímos os coeficientes na equação:
Nahco3 → ½. N / D2Co3 + ½. H2O + ½.Co2
Multiplamos em ambos os lados da seta por 2, pois é o único denominador presente, para eliminar a fração:
2nahco3 → Na2Co3 + H2Ou + co2
Contamos o número de átomos presentes à esquerda: 2 átomos de Na, H e C e 6 de O. O leitor pode verificar se cada um deles também está presente à direita nas mesmas quantidades.
Referências
- Atkins, p. Princípios da química: os caminhos da descoberta. Editorial médico pan -American. 3ª edição.
- Briceño, j. Guia de química USB. Recuperado de: gecousb.com.ir.
- Chang, R. 2013. Química. 11VA. Edição. Mc Graw Hill Education.
- Exercícios resolvidos. Balanceamento algébrico. Recuperado de: exercícios Sueled.co.
- Simoza, l. Balanceamento de equações químicas. Recuperado de: guao.org.
- « Características de cobranças mortas, cálculo, exemplos
- Recursos de arquitetura inca e construções excelentes »

