Momento dipolar como é calculado e exemplos

- 1368
- 392
- Ralph Kohler
Ele Momento dipolar É uma propriedade química que indica quão heterogeneamente as cargas elétricas são distribuídas em uma molécula. É expresso em unidades de Debye, 3,33 · 10-30 C · m, e geralmente seus valores variam de 0 a 11 d.
Compostos altamente polares tendem a ter grandes momentos dipolares; Enquanto o apolar, pequenos momentos dipolares. Quanto mais polarizada as cargas elétricas estão em uma molécula, maior o momento do dipolo; isto é, deve haver uma região rica em elétrons, Δ- e outra pobre em elétrons, δ+.
 O rascunho de dois policiais serve como uma analogia a dois pólos, positivos e negativos, de uma molécula com um momento de dipolo acentuado. Fonte: pexels.
O rascunho de dois policiais serve como uma analogia a dois pólos, positivos e negativos, de uma molécula com um momento de dipolo acentuado. Fonte: pexels. O momento dipolar, μ, é uma magnitude vetorial, por isso é afetada pelos ângulos dos links e, em geral, pela estrutura molecular.
Quando a molécula é linear, ela pode ser comparada a um rascunho de duas coloridas. Sua extremidade negativa Δ-, corresponderia à cor vermelha; Enquanto o positivo, Δ+, seria a cor azul. À medida que as magnitudes de cargas negativas aumentam no Δ-pólo e a distância que o separa de Δ+, o momento dipolar aumenta.
Quimicamente o exposto acima significa que quanto maior a diferença na eletronegatividade entre dois átomos, e quanto maior a distância que os separa, maior o momento dipolo entre eles.
[TOC]
Como o momento dipolar é calculado?
É considerado uma ligação covalente entre dois átomos, A e B:
A-b
A distância entre cargas parciais positivas e negativas já está definida pelo comprimento de seu link:
PARAδ+-Bδ-
Porque prótons e elétrons têm a mesma magnitude de carga elétrica, mas com sinais opostos, 1.6 · 10-19C, este é o que é levado em consideração ao avaliar o momento dipolo entre A e B através da seguinte equação:
Pode atendê -lo: diferenças entre compostos orgânicos e inorgânicosμ = δ ·d
Onde μ é o momento dipolo, δ é a carga do elétron sem o sinal negativo e d O comprimento do link expresso em medidores. Por exemplo, assumindo que d Tem um valor de 2 Å (1 · 10-10m) O momento do dipolo, μA-B será:
μA-B = (1.6 · 10-19C) · (2 · 10-10m)
= 3,2 · 10-29Cm
Mas como esse valor é muito pequeno, a unidade Deby é usada:
μ = (3,2 · 10-29C · m) · (1 d/3,33 · 10-30 Cm)
= 9,60 d
Esse valor μA-B pode assumir que o link A-B é mais iônico do que covalente.
Exemplos
Água
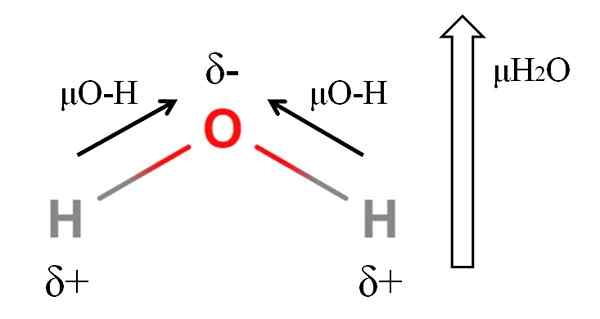 Momento dipoar de uma molécula de água. Fonte: Gabriel Bolívar.
Momento dipoar de uma molécula de água. Fonte: Gabriel Bolívar. Para calcular o momento dipolar de uma molécula, você deve adicionar todos os momentos dipolares de seus respectivos links, considerando os ângulos dos links e um pouco de trigonometria. Isso a princípio.
A água tem um dos maiores momentos dipolares que se poderia esperar para um composto covalente. Na imagem superior, temos que os átomos de hidrogênio têm cargas parciais positivas, Δ+, enquanto o oxigênio carrega a carga parcial negativa, δ-. O link O-H é bastante polar (1.5d), e há dois deles em uma molécula H2QUALQUER.
Em geral, um vetor é extraído do átomo menos eletronegativo (h) para o mais eletronegativo (O). Embora eles não sejam desenhados, no átomo de oxigênio, existem dois pares de elétrons não compartilhados, que "concentram" a região negativa ainda mais.
Devido à geometria angular de H2Ou, os momentos dipolares se juntam na direção do átomo de oxigênio. Observe que a soma dos dois μo-h daria 3D (1.5+1.5); mas não é assim. O momento dipolo da água tem um valor experimental de 1.85d. Aqui está o efeito do ângulo de fechamento de 105º entre os links H-O-H.
Pode servir a você: Termômetro de laboratório: características, para que serve, uso, exemplosMetanol
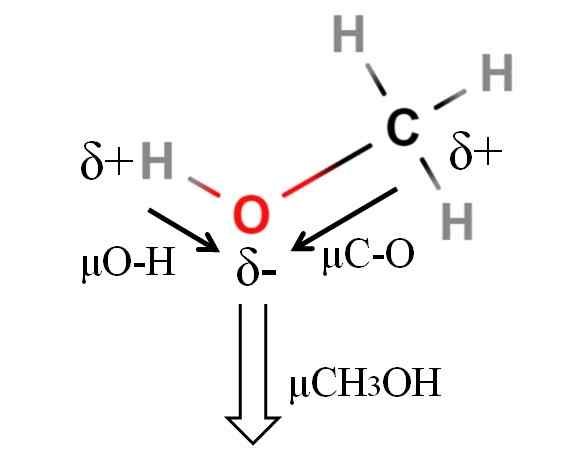 Momento dipoar de uma molécula de metanol. Fonte: Gabriel Bolívar.
Momento dipoar de uma molécula de metanol. Fonte: Gabriel Bolívar. O momento dipolo do metanol é 1.69d. É menor que água. Portanto, as massas atômicas não têm muita influência no momento dipolar; Mas seus rádios atômicos. No caso de metanol, não podemos afirmar que seu link H-O tem um μ igual a 1.5 d; Desde então, ambientes moleculares são diferentes em CHO3Oh e h2QUALQUER.
É por isso que teríamos que medir o comprimento do link H-O no metanol para poder calcular μo-h. O que pode ser afirmado é que μo-h é maior que μc-o.
O metanol é catalogado como um dos solventes mais polares que podem ser encontrados juntamente com água e amônia.
Amônia
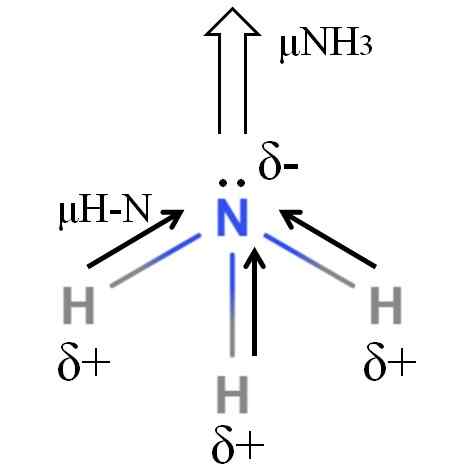 Momento Dipoar de uma molécula de amônia. Fonte: Gabriel Bolívar.
Momento Dipoar de uma molécula de amônia. Fonte: Gabriel Bolívar. As ligações H-N são bastante polares, portanto, o nitrogênio após sua maior eletronegatividade atrai elétrons em direção a si (imagem superior). Além disso, nele, temos alguns elétrons não utilizados, que contribuem com suas cargas negativas para a região δ-. Portanto, as cargas elétricas predominam no átomo de nitrogênio de amônia.
A amônia tem um momento dipolar de 1.42d, menor que o de metanol. Se tanto a amônia quanto o metanol poderiam ser transformados em rascunhos, seria visto que o rascunho do metanol tem mais pólos definidos em comparação com o rascunho da amônia.
Etanol
No caso do etanol, Cho3CH2Oh seu momento dipolar está muito próximo do de metanol, mas tende a ter valores mais baixos. Tendo mais átomos de carbono que compõem a região Δ+, o átomo de oxigênio representando Δ-, começa a perder um pouco de sua "intensidade negativa relativa".
Pode atendê -lo: dimetilamina ((CH3) 2NH): estrutura, propriedades, usos, riscosDióxido de carbono
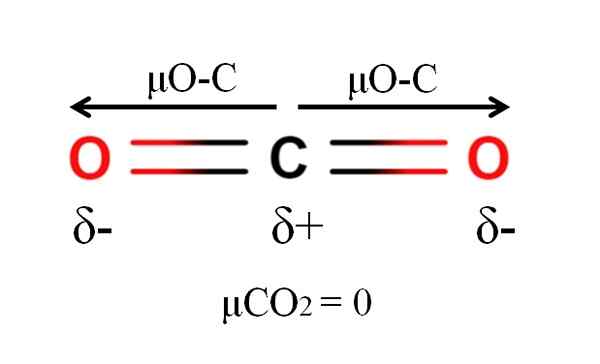 Momento dipoar de uma molécula de dióxido de carbono. Fonte: Gabriel Bolívar.
Momento dipoar de uma molécula de dióxido de carbono. Fonte: Gabriel Bolívar. Dióxido de carbono tem duas ligações polares, c = O, com seus respectivos momentos dipolares μo-c. No entanto, como pode ser visto na imagem superior, a geometria linear do CO2 faz com que os dois μo-c se cancelem vetorialmente, mesmo que o carbono tenha uma carga parcial positiva e as cargas parciais negativas de oxigênio.
Por esse motivo, o dióxido de carbono é uma molécula apolar, porque μco2 tem um valor de 0d.
Metano
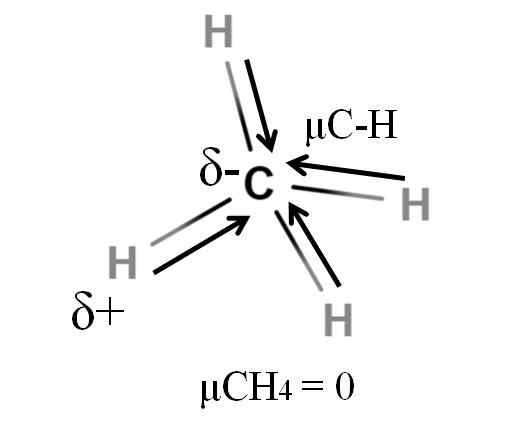 Momento dipolar para uma molécula de metano. Fonte: Gabriel Bolívar.
Momento dipolar para uma molécula de metano. Fonte: Gabriel Bolívar. Tanto o metano quanto o dióxido de carbono compartilham algo em comum: são moléculas altamente simétricas. Em geral, quanto mais simétrica uma molécula, menos o seu momento dipolar será.
Se vermos a molécula de Cho4, Suas ligações C-H são polares e os elétrons são direcionados para o átomo de carbono porque são um pouco mais eletronegativos. Pode -se pensar que o carbono teria que ser uma região δ altamente negativa; como um rascunho com seu intenso centro vermelho e suas extremidades azuladas.
No entanto, quando o CHO é dividido4 Na metade, obteríamos duas metades H-C-H, uma à esquerda e a outra a direita, semelhante à molécula H2QUALQUER. Assim, o momento dipolar resultante da adição desses dois μc-h é cancelado com o da outra metade. E, portanto, μCH4 tem um valor de 0d.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Walter J. Moore. (1963). Química Física. Em cinética química. Quarta edição, Longmans.
- Irã. Levine. (2009). Princípios da físico -química. Sexta edição, página 479-540. Mc Graw Hill.
- Helmestine, Anne Marie, Ph.D. (29 de janeiro de 2020). Definição do momento dipolo. Recuperado de: pensamento.com
- Blaber Mike. (29 de setembro de 2019). Momentos dipolares. Química Librettexts. Recuperado de: química.Librettexts.org
- Larita Williams. (2020). Momento dipolar: Definição, equação e exemplo. Estudar. Recuperado de: estudo.com
- Wikipedia. (2020). Momento dipolar de títulos. Recuperado de: em.Wikipedia.org
- « Iluminação de gases como detectá -lo e 5 dicas para evitá -lo
- Características de onomatopeia, função, tipos, exemplos »

