Molalidade

- 4446
- 321
- Gilbert Franecki
O que é a molalidade?
O Molalidade, denotado com a letra m em minúsculas, é um termo usado para descrever a concentração de uma solução. Pode ser definido como o número de moles de um soluto dissolvido em 1 kg de solvente.
É igual às moles de soluto (a substância que se dissolve) dividida pelos quilogramas de solvente (a substância usada para se dissolver).

Onde as toupeiras de soluto são dadas pela equação:
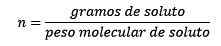
Então, no final, a equação da moleidade permanece
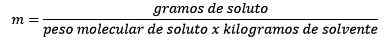
Características da molalidade
- Molalidade é uma medida da concentração de um soluto em uma solução. É usado principalmente quando a temperatura é uma preocupação.
- A molalidade não é tão comum quanto sua contraparte, molaridade (moles de soluto para cada litro de solvente), mas é usada em cálculos muito específicos, especialmente no que diz respeito às propriedades coligativas (elevação do ponto de ebulição, depressão do ponto de congelamento). Como o volume está sujeito a variação devido à temperatura e pressão, a molaridade também varia de acordo com a temperatura e a pressão.
- Em alguns casos, o uso de peso é uma vantagem porque a massa não varia com as condições ambientais.
- É importante que a massa solvente e não a massa da solução seja usada.
- As soluções marcadas com concentração moral são indicadas com um min em minúsculas. Uma solução de 1,0 m contém 1 mol de soluto por quilograma de solvente.
- A preparação de uma determinada solução de moralidade é fácil porque requer apenas uma boa escala. Tanto o solvente quanto o soluto são misturados, em vez de serem medidos por volume.
Pode servir você: ácido de propano- A unidade SI (sistema internacional) para moleidade é mol/kg, ou moles soluto por kg de solvente. Uma solução com uma moleidade de 1 mol/kg é frequentemente descrita como "1 mole" ou "1 m".
No entanto, seguindo o sistema de unidades de SI, o Instituto Nacional de Padrões e Tecnologia, que é a autoridade dos Estados Unidos sobre medição, considera que o termo "moral" e o símbolo da unidade "M" são obsoletos e sugere usar mol/kg.
Diferenças e semelhanças entre a molalidade (M) e a molaridade (M)
A preparação de uma solução de uma dada moralidade implica pesando o soluto e o solvente e a obtenção de suas massas.
Mas, no caso da molaridade, o volume da solução é medido, o que deixa espaço para variações de densidade como resultado da condição ambiental e de pressão.
Isso significa que é uma pressão vantagem enquanto a massa permanece inalterada.
Além disso, reações químicas ocorrem em proporção de massa, e não volume. Para confiar na massa, a molalidade pode facilmente se tornar uma proporção de massa ou uma fração de massa.
Para soluções aquosas (soluções nas quais a água é solvente) perto da temperatura ambiente, a diferença entre soluções morais e molares é desprezível.
Isso ocorre porque em torno da temperatura ambiente, a água tem uma densidade de 1 kg / l. Isso significa que o "por l" da molaridade é igual ao "por kg" da molalidade.
Pode atendê -lo: caseinato de cálcio: estrutura, propriedades, obtenção e usoPara um solvente como o etanol, onde a densidade é de 0,789 kg / L, uma solução de 1 m seria de 0,789 m.
A parte importante de lembrar a diferença é:
Molaridade - M → Moles por litro de solução.
Molalidade - M → Moles por quilograma de solvente.
Exemplos de molalidade
Exemplo 1
Problema: Qual é a moralidade de uma solução contendo 0.086 moles de NaCl dissolvido em 25,0 g de água?
Responder: Neste exemplo, a equação moral direta é usada:
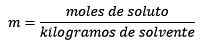
Moles de soluto (NaCl) = 0,086 mol
Massa (água) = 25,0 g = 25,0 x 10-3 kg
Substituindo que você tem:
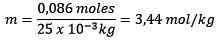
Exemplo 2
Problema: Qual é a moralidade de uma solução se 124,2 gramas de NaOH se dissolvem em 1,00 litros de água? (A densidade da água é igual a 1,00 g/ml).
Responder: A água é conhecida como solvente universal e densidade geralmente é dada cerca de 1,00 gramas por mililitro, ou o que é o mesmo, 1 kg por litro. Isso facilita a conversão de litros para quilogramas.
Nesse problema, os 124,2 gramas de NaOH terão que ser convertidos em toupeiras (para moles de soluto) e um litro de água terá que ser transformado em quilogramas (por quilogramas de solvente) usando a densidade.
Primeiro, há a massa molar de Naoh:
PMN / D= 22,99 g/mol
PMQUALQUER= 16 g/mol
PMH= 1g/mol
PMNaoh= 22,99 g/mol +16 g/mol +1 g/mol = 39,99 g/mol
Segundo, os gramas de Naoh se convertem em toupeiras, usando a massa molar:
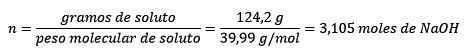
Em terceiro lugar, o litro de água se torna quilogramas usando densidade:
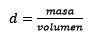
Limpar a massa permanece:
Pode atendê -lo: óxido de ouro (iii) (AU2O3): o que é, estrutura, propriedades, usa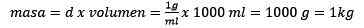
Finalmente, a equação do molelismo é resolvida:
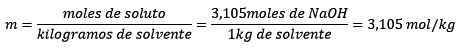
Exemplo 3
Problema: Qual é a massa de água de uma solução aquosa que contém 0,52 gramas de cloreto de bário (BACL2, Pm = 208,23 g/mol) cuja concentração é 0,005 mol/kg?
Responder: Nesse caso, a concentração moral é usada para determinar a quantidade de água em solução.
Primeiro, o número de moles de BACL é obtido2 Na solução:
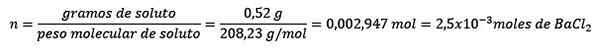
Segundo, os quilogramas de solvente são limpos da equação de molelismo e resolvidos.
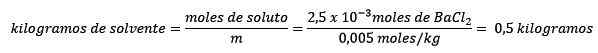
Referências
- Cálculo do problema de exemplo de molalidade. Recuperado de ciententes.org.
- O que é um exemplo de molalidade? Recuperado do socrático.org.
- (S.F.). Moralidade. Recuperado de ilimitado.com.

