Características do modelo atômico de Sommerfeld, postulações, vantagens e desvantagens
- 4974
- 713
- Pete Wuckert
Ele Modelo Atômico Sommerfeld Foi criado pelo físico alemão Arnold Sommerfeld entre 1915 e 1916, para explicar os fatos que o modelo Bohr, divulgado pouco antes em 1913, não pôde explicar satisfatoriamente. Sommerfeld apresentou seus resultados primeiro à Academia de Ciências da Baviera e depois os publicou na revista Annalen Der Physik.
O modelo Atom proposto pelo físico dinamarquês Niels Bohr descreve.
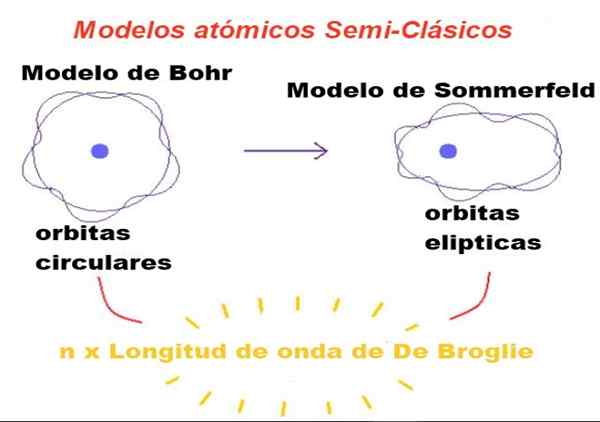
 figura 1. Em modelos semi-clássicos, as órbitas são newtonianas, mas apenas aquelas cujo perímetro é um número inteiro de vezes o comprimento de onda de Broglie é permitido. Fonte: f. Zapata.
figura 1. Em modelos semi-clássicos, as órbitas são newtonianas, mas apenas aquelas cujo perímetro é um número inteiro de vezes o comprimento de onda de Broglie é permitido. Fonte: f. Zapata. Na teoria proposta por Bohr, o elétron que orbita ao redor do núcleo só pode ter certos valores de seu momento angular orbital e, portanto, não pode ser em qualquer órbita.
Bohr também considerou que essas órbitas eram circulares e um único número quântico chamado Número quântico principal n = 1, 2, 3 ... serviu para identificar as órbitas permitidas.
A primeira modificação introduzida por Sommerfeld no modelo BOHR consistia em assumir que a órbita eletrônica também pode ser elíptica.
Uma circunferência é descrita por seu raio, mas para uma elipse você deve dar dois parâmetros: semi -senije e metade menor -semi, além da orientação espacial do mesmo. Com isso, ele introduziu mais dois números quânticos.
A segunda modificação principal que Sommerfeld fez foi adicionar efeitos relativísticos ao modelo atômico. Não há nada mais rápido que a luz, no entanto, Sommerfeld encontrou elétrons com velocidades grossas, portanto, era necessário incorporar os efeitos relativísticos em qualquer descrição do átomo.
[TOC]
Postulados do modelo atômico de Sommerfeld
Os elétrons seguem órbitas circulares e elípticas
Os elétrons no átomo seguem a órbita elíptica (as órbitas circulares são um caso específico) e seu status de energia pode ser caracterizado por 3 números quânticos: o principal número quântico n, O número quântico secundário ou número azimutal eu e o número quântico magnético meu.
Pode atendê -lo: sais bináriosAo contrário da circunferência, uma elipse tem um semije maior e uma metade menor.
Mas as elipses com o mesmo grande eixo -eixo, eles podem ter meio menor -SEMI, dependendo do grau de excentricidade. Uma excentricidade igual a 0 corresponde a um círculo, por isso não descarta trajetórias circulares. Além disso, no espaço elipses podem ter inclinações diferentes.
É por isso que Sommerfeld adicionou ao seu modelo o número quântico secundário l para indicar a metade menor e o número quântico magnético Meu. Assim, ele apontou quais são as orientações espaciais permitidas da órbita elíptica.
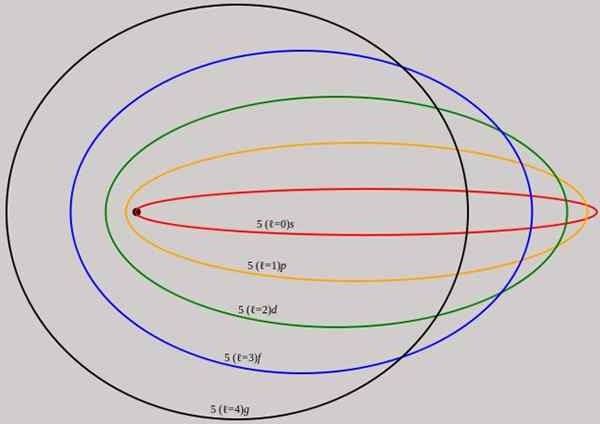 Figura 2. As órbitas correspondentes ao nível de energia n = 5 são mostradas para diferentes momentos angulares L que têm comprimentos de onda completos de De Broglie. Fonte: Wikimedia Commons.
Figura 2. As órbitas correspondentes ao nível de energia n = 5 são mostradas para diferentes momentos angulares L que têm comprimentos de onda completos de De Broglie. Fonte: Wikimedia Commons. Observe que ele não adiciona novos números quânticos principais; portanto, a energia total do elétron em órbita elíptica é a mesma que no modelo bohr. Portanto, não há novos níveis de energia, mas um desdobramento dos níveis dados pelo número n.
Efeito Zeeman e Efeito Stark
Dessa maneira, é possível especificar completamente uma dada órbita, graças aos três números quânticos mencionados e, assim, explicar a existência de dois efeitos: o efeito Zeeman e o efeito Stark.
E explica o desdobramento da energia que aparece no efeito Zeeman normal (há também um efeito anômalo de Zeeman), no qual uma linha espectral é dividida em vários componentes quando está na presença de um campo magnético.
Esse desdobramento das linhas também ocorre na presença de um campo elétrico, conhecido como efeito Stark, que levou Sommerfeld a pensar na modificação do modelo Bohr para explicar esses efeitos.
O núcleo atômico e os elétrons se movem em torno de seu centro de massa
Depois que Ernest Rutherford descobriu o núcleo atômico e que o fato de que quase toda a massa do átomo está concentrada lá, os cientistas acreditavam que o núcleo era mais ou menos estacionário.
Pode atendê -lo: hidróxido de lítio (lioh)No entanto, Sommerfeld postulou que tanto o núcleo quanto os elétrons na órbita se movem ao redor do centro de massa do sistema, o que obviamente está muito próximo do núcleo. Seu modelo usa a massa reduzida do sistema eletrônico - núcleo, em vez da massa de elétrons.
Nas órbitas elípticas, como nos planetas ao redor do sol, há momentos em que o elétron está mais próximo e em outros mais longe do núcleo. Portanto, sua velocidade é diferente em cada ponto de sua órbita.
 Figura 3.- Arnold Sommerfeld. Fonte: Wikimedia Commons. Gfhund [CC por 3.0 (https: // CreativeCommons.Org/licenças/por/3.0)].
Figura 3.- Arnold Sommerfeld. Fonte: Wikimedia Commons. Gfhund [CC por 3.0 (https: // CreativeCommons.Org/licenças/por/3.0)]. Os elétrons podem atingir velocidades relativísticas
Sommerfeld introduziu em seu modelo a constante de estrutura fina, uma constante sem dimensões relacionadas à força eletromagnética:
α = 1/137.0359895
É definido como o quociente entre a carga de elétrons e Eu quadrado alto e o produto entre a constante de Planck h e a velocidade da luz c No vácuo, tudo multiplicado por 2π:
α = 2π (e2/h.c) = 1/137.0359895
A estrutura fina constante relaciona três das constantes mais importantes da física atômica. O outro é a massa do elétron, que não aparece aqui.
Dessa maneira, está ligado aos elétrons com os fótons (que se movem na velocidade C no vazio) e, assim, explique os desvios de algumas linhas espectrais do átomo de hidrogênio das previsões pelo modelo BOHR.
Graças às correções relativísticas, níveis de energia com iguais n Mas diferente eu Eles se separam, dando origem à estrutura fina, a partir daí o nome da constante α.
E todos os comprimentos característicos do átomo podem ser expressos em termos dessa constante.
 Figura 4. A quantização do momento angular l é mostrada. Ao contrário das órbitas circulares, elíptica. Fonte: f. Zapata.
Figura 4. A quantização do momento angular l é mostrada. Ao contrário das órbitas circulares, elíptica. Fonte: f. Zapata. Vantagens e desvantagens
Vantagens
-Sommerfeld mostrou que um único número quântico era insuficiente para explicar as linhas espectrais do átomo de hidrogênio.
-Foi o primeiro modelo a propor uma quantização espacial, uma vez que as projeções das órbitas na direção do campo eletromagnético são, na verdade, quantizadas.
Pode atendê -lo: Estado do plasma: características, tipos e exemplos-O modelo Sommerfeld explicou satisfatoriamente que os elétrons com o mesmo número quântico principal n diferem em seu estado de energia, pois eles podem ter diferentes números quânticos L e Meu.
-Introduziu o α constante para desenvolver a estrutura fina do espectro atômico e explicar o efeito Zeeman.
-Incluiu os efeitos relativísticos, já que os elétrons podem se mover com velocidades bem próximas da luz.
Desvantagens
-Seu modelo era aplicável apenas a átomos com um elétron e, de várias maneiras, aos átomos dos metais alcalinos como Li2+, Mas não é útil no átomo de hélio, que possui dois elétrons.
-Não explicou a distribuição eletrônica no átomo.
-O modelo permitiu calcular as energias dos estados permitidos e as frequências da radiação emitidas ou absorvidas nas transições entre os estados, sem fornecer informações sobre os tempos dessas transições.
-Agora sabe -se que os elétrons não seguem trajetórias com formas predeterminadas como órbitas, mas que ocupam Orbitais, regiões espaciais correspondentes às soluções de equação de Schrodinger.
-O modelo combinou arbitrariamente aspectos clássicos com aspectos quânticos.
-Ele falhou em explicar o efeito anômalo Zeeman, pois isso é necessário pelo modelo Dirac, que mais tarde adicionou outro número quântico.
Artigos de interesse
Modelo Atômico de Schrödinger.
Modelo Atômico de Broglie.
Modelo Atômico de Chadwick.
Modelo Atômico de Heisenberg.
Modelo atômico de perrina.
Modelo Atômico de Thomson.
Modelo atômico de Dalton.
Modelo Atômico Dirac Jordan.
Modelo Atômico de Leucipo.
Modelo atômico Bohr.
Modelo atômico atual.
Referências
- Brainkart. Sommerfeld Atom Model e suas desvantagens. Recuperado de: Brainkart.com.
- Como chegamos a conhecer o Cosmos: Light & Matter. Átomo de Sommerfeld. Retirado de: Tastargarden.co.Reino Unido
- Parker, p. O átomo Bohr-Sommerfeld. Recuperado de: Physnet.org
- Canto educacional. Modelo Sommerfeld. Recuperado de: rinconucativo.com.
- Wikipedia. Modelo Atômico Sommerfeld. Recuperado de: é.Wikipedia, org.
- « Quais são os componentes naturais da terra?
- Fórmula Geral Equações Quadráticas, Exemplos, Exercícios »

