Tipos, estrutura e organização de miofilamentos
- 3474
- 739
- Gilbert Franecki
O Miofilamentos São as proteínas contráteis das miofibrilas, que são as unidades estruturais das células musculares, células alongadas que são chamadas de fibras musculares.
Fibras musculares e seus componentes têm nomes particulares. Por exemplo, membrana, citoplasma, mitocôndrias e retículo endoplasmático são conhecidos como sarcolema, sarcoplasma, sarcosomas e retículo sarcoplasmático, respectivamente.
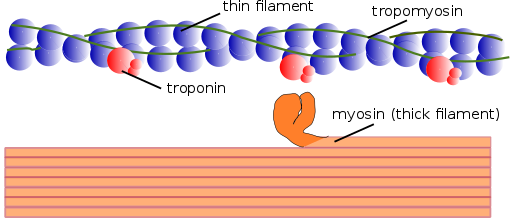
 Estrutura dos miofilamentos (fonte: Mikael Häggström, usado com permissão. [Domínio público] via Wikimedia Commons)
Estrutura dos miofilamentos (fonte: Mikael Häggström, usado com permissão. [Domínio público] via Wikimedia Commons) Da mesma forma, os elementos contráteis internos são chamados de miofibrilas juntos; E as proteínas contráteis que compõem as miofibrilas são chamadas de miofilamentos.
Existem dois tipos de miofilamentos: finos e espessuras. Filamentos finos são compostos principalmente de três proteínas: actina F, tropomiosina e troponina. Enquanto isso, filamentos espessos são compostos apenas de outra proteína conhecida como Myosina II.
Além disso, existem outras proteínas associadas a filamentos espessos e finos, mas estes não têm funções contráteis, se não bastante estruturais, entre as quais são, para citar alguns, titine e nebulina.
[TOC]
Tipos de fibras musculares
A disposição particular dos miofilamentos que constituem miofibrilas dá origem a dois tipos de fibras musculares: fibras musculares estriadas e fibras musculares lisas.
As fibras musculares forçadas, ao examinar um microscópio óptico, mostram um padrão de estrierica ou bandas transversais que são repetidas ao longo de toda a sua superfície e que concedem o nome, ao músculo que as contém, de músculo estriado. Existem dois tipos de fibras musculares estriadas, esqueléticas e cardíacas.
Fibras musculares que não mostram que o padrão de bandas cruzadas é chamado de fibras lisas. Eles são os que compõem a musculatura de paredes vasculares e vísceras.
Estrutura
Miofilamentos finos
Esses miofilamentos são compostos de actina F e duas proteínas associadas: tropomiosina e troponina, que têm funções regulatórias.
Actina F, ou actina filamentosa é um polímero de outra proteína globular menor chamada actina G ou actina globular, de cerca de 42 kDa de peso molecular. Possui um local de sindicato para miosina e é ordenado a formar duas cadeias organizadas como uma hélice dupla composta aproximadamente 13 monômero por turno.
Pode atendê -lo: proteólise: tipos e funçõesOs filamentos de actina F são caracterizados por ter dois pólos: um positivo, direcionado ao disco z e outro negativo, dispostos em direção ao centro do sarcômero.
A tropomiosina também é composta por uma cadeia polipeptídica dupla dupla hélice. É uma proteína de 64 kDa que forma filamentos que estão localizados nos sulcos deixados pelas cadeias duplas de hélice dos finos filamentos da actina F, como "encher" os espaços vazios na hélice.
Em repouso, tampas de tropomiosina ou "tampa" os locais da união da actina para a miosina, impedindo a interação de ambas as proteínas, que é o que causa a contração muscular. Em torno de cada filamento fino e cerca de 25 ou 30ηm do início de cada tropomiosina é outra proteína chamada troponina.
A troponina (TN) é um complexo proteico composto por três subunidades de polipeptídeos globulares chamados troponina T, C e I. Cada molécula de tropomiosina possui um complexo de troponina associado que a regula, e juntos eles são responsáveis pela regulação do início e conclusão da contração muscular.
Miofilamentos grossos
Filamentos grossos são polímeros de miosina II, que pesa 510 kDa e são formados por duas cadeias pesadas de 222 kDa cada e quatro correntes leves. As cadeias leves são de dois tipos: cadeias leves essenciais, 18 kDa e cadeias leves regulatórias de 22 kDa.
Cada cadeia pesada de Myosina II tem a forma de uma bengala com uma pequena cabeça globular na extremidade que é projetada quase 90⁰ e tem dois sites de fixação, um para actina e outro para o ATP. É por isso que essas proteínas pertencem à família Atasas.
Um filamento grosso é composto de mais de 200 moléculas de miosina II. A cabeça globular de cada uma dessas moléculas atua como um "remo" durante a contração, empurrando a actina a que está ligada para que ela caia em direção ao centro do sarcomaro.
Organização
Em uma fibra muscular esquelética, as miofibrilas ocupam a maior parte do sarcoplasma e são dispostas em conjuntos longitudinais e ordenados em toda a célula.
Pode atendê -lo: MitocôndriasEm um corte longitudinal visto com um microscópio óptico, faixas leves, bandas I e bandas escuras, chamadas bandas A Bands são observadas. Essas bandas correspondem à disposição ordenada das miofibrilas e, portanto, dos miofilamentos que os compõem.
No centro da banda, há uma linha escura e fina chamada linha ou disco z. O centro de cada banda A apresenta uma área mais clara conhecida como banda H, que é dividida centralmente por uma linha mais escura chamada M Line.
Delimitado entre duas linhas z, é descrita uma estrutura chamada sarcomer, que é a unidade funcional do músculo esquelético. Um sarcômer é composto pelos miofilamentos contráteis dispostos nas bandas A, H e uma banda hemi em cada extremidade.
Bandas que eu conto apenas filamentos finos, a banda contém filamentos grossos entrelaçados em suas duas extremidades com filamentos finos e a banda H contém apenas filamentos grossos.
Como os miofilamentos são organizados em sarcômeros?
Miofilamentos espessos e miofilamentos finos podem ser observados ao examinar uma amostra de músculo esquelético no microscópio eletrônico. Dizem que estes que são "interdign" ou "entrelaçados" entre si em uma disposição sequencial, ordenada e paralela.
Os filamentos finos se originam nos discos Z e se estendem a cada lado na direção oposta e em direção ao centro de cada sarcômere adjacente. Dos discos z em cada extremidade do sarcômero, no músculo descontraído, a actina chega ao início da banda H de cada lado.
Assim, nas fibras musculares do músculo esquelético, os miofilamentos espessos relaxados ocupam a área central que forma as faixas escuras ou faixas a; E os filamentos finos se estendem de ambos os lados do sarcomer sem chegar ao centro.
Em uma seção cruzada na região onde os filamentos grossos e finos se sobrepõem, pode -se observar um padrão hexagonal que inclui o filamento grosso no centro e seis filamentos finos que o cercam e que estão localizados em cada uma das bordas hexagonais do The the hexágono.
Pode atendê -lo: Simpasto: peças e característicasEssa organização de miofilamentos no sarcômero é preservada pela função de uma série de proteínas associadas a miofilamentos e que possuem funções estruturais, entre as quais o titino, a alfa actina, a nebulina, a miomesina e a proteína C podem ser destacadas.
Mecanismo de contração
Quando a acetil colina (um neurotransmissor) é liberada na placa neuromuscular devido à estimulação de um neurônio motor, a fibra muscular é excitada e os canais de cálcio dependentes de tensão dos retículos sarcoplasmáticos são abertos.
O cálcio se liga à troponina C, e isso gera uma mudança conformacional na tropomiosina, que expõe locais ativos, iniciando assim a contração. Quando os níveis de cálcio caem, a tropomiosina retorna à sua posição inicial e a contração cessa.
A exposição dos locais da união da actina com miosina permite que ambas as proteínas se juntem e que a miosina empurrou a actina em direção ao centro do sarcômere, deslizando sobre miosina.
Durante a contração muscular, as linhas Z de cada sarcomer se aproximam do centro, aproximando -se da linha M, aumentando a interdigitação entre actina e miosina e reduzindo o tamanho das bandas I e H. O grau de encurtamento dependerá da soma do encurtamento de cada um dos sarcomers do músculo contratado.
Referências
- Berne, r., & Levy, M. (1990). Fisiologia. Mosby; Edição Internacional.
- Fox, s. Yo. (2006). Fisiologia humana (9ª ed.). Nova York, EUA: McGraw-Hill Press.
- Gartner, l., & Hiatt, j. (2002). Texto da Histologia Atlas (2ª ed.). México d.F.: Editores interamericanos de McGraw-Hill.
- Murray, r., Bender, d., Botham, k., Kennelly, p., Rodwell, v., & Weil, P. (2009). Bioquímica ilustrada de Harper (28ª ed.). McGraw-Hill Medical.
- Rawn, j. D. (1998). Bioquímica. Burlington, Massachusetts: Neil Patterson Publishers.
- Ross, m., & Pawlina, w. (2006). Histologia. Um texto e atlas com células correlacionadas e biologia molecular (5ª ed.). Lippinott Williams & Wilkins.
- West, J. (1998). Base fisiológica da prática médica (12ava ed.). México d.F.: Pan -American Medical Editorial.
- « Características, funções e patologias do promiielocito
- Características de girafa, habitat, reprodução, comida »

