Mistura Rankic Quiraral, exemplos
- 634
- 21
- Mr. Reginald Lindgren
A Mix racmica o racmático é o composto por dois enantiômeros em partes iguais e, portanto, é opticamente inativo. Esta atividade óptica refere -se à capacidade de suas soluções de girar, em um cronograma ou anti -desfile, um feixe de luz polarizada que viaja através deles em uma direção.
Um enantiômero tem a capacidade de girar a luz polarizada, digamos, para a esquerda (levóguiro), então sua solução pura será opticamente ativa. No entanto, se isso começar a adicionar o enantiômero que gira a luz para a direita (Dextrogyry), sua atividade óptica diminuirá até que seja inativada.
 Clusters de uva, que compartilham um parentesco com misturas rankic além da etimologia. Fonte: pexels.
Clusters de uva, que compartilham um parentesco com misturas rankic além da etimologia. Fonte: pexels. Quando isso acontece, diz -se que existem as mesmas quantidades dos enantiômeros de Levogiro e Dextrógiro; Se uma molécula quebrou a luz polarizada à esquerda, seu efeito será cancelado imediatamente quando for "tropeçar" com outra molécula que a gira para a direita. E assim por diante. Portanto, teremos uma mistura Rankic.
O primeiro avistamento de aprimoramento foi feito pelo químico francês Louis Pasteur em 1848, que estudou uma mistura de cristais enantioméricos de ácido tartárico (naquela época chamado ácido rankic). Quando esse ácido das uvas usadas para a produção de vinho, essa mistura acabou se aplicando de maneira geral para todas as moléculas.
[TOC]
Sapatos e quiralidade
Em primeiro lugar, há uma mistura de raciocínio, deve haver dois enantiômeros (comuns), o que implica que ambas. Um par de sapatos ilustra isso perfeitamente: não importa o quanto o sapato esquerdo seja tentado à direita, eles nunca podem caber.
Pode atendê -lo: ácido fracoO sapato direito, para dizer, desvia a luz polarizada para a esquerda; Enquanto o sapato esquerdo faz isso à direita. Em uma solução hipotética em que os sapatos são as moléculas, se houver apenas direitos de direitos, quirais, isso será opticamente ativo. Da mesma maneira, isso acontecerá se houver apenas sapatos deixados em solução.
No entanto, se houver mil sapatos de esquerda misturados com mil sapatos, há uma mistura Rankic, que também é opticamente inativa, uma vez que os desvios sofridos pela luz interna são cancelados mutuamente.
Se, em vez de sapatos, fossem bolas, objetos que são aquirais, seria impossível para eles existirem misturas rankic dessas, porque elas nem seriam capazes de existir como pares enantioméricos.
Exemplos
Ácido tartárico
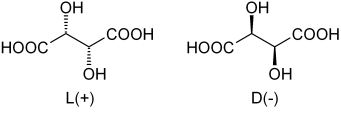 Enantimers de ácido tartárico. Fonte: Dschanz [Domínio Público]
Enantimers de ácido tartárico. Fonte: Dschanz [Domínio Público] Voltando ao ácido tartárico, sua mistura Rankic foi a primeira a se encontrar. Na imagem superior, seus dois enantiômeros são mostrados, cada um capaz de formar cristais com rostos morfológicos de "esquerda" ou "direita". Pasteur, ajudando um microscópio e um esforço rigoroso, conseguiu separar esses cristais enantioméricos um do outro.
Os cristais dos enantiômeros L (+) e D (-) separadamente, apresentam atividade óptica, desviando a luz polarizada à direita ou à esquerda, respectivamente. Se ambos os cristais nas mesmas proporções molares se dissolverem na água, uma mistura Rankic opticamente inativa será obtida.
Observe que ambos os enantiômeros têm dois carbonos quirais (com quatro substituintes diferentes). No L (+), o OH está atrás do plano formado pelo esqueleto de carbono e pelos grupos COOH; Enquanto estiver em D (-), esses estão acima do referido avião.
Aqueles que sintetizam o ácido tartárico obterão uma mistura rankic. Para separar o enantiômero L (+) de D (-), é necessária uma resolução quiral, na qual essa mistura é reagida com uma base quiral para produzir sais de diateroisomeros, capazes de se separar então por cristalização fracionária.
Pode atendê -lo: sulfeto de cobre: estrutura, propriedades, usosQuinina
 Esqueleto estrutural da molécula quinina. Fonte: Benjah-BMM27.
Esqueleto estrutural da molécula quinina. Fonte: Benjah-BMM27. No exemplo anterior, para se referir a uma mistura rankic de ácido tartárico, geralmente é escrito como ácido (±) -tartaric. Assim, no caso de quinina (imagem superior), será (±) -Qinina.
A isomeria do quinino é complexa: possui quatro carbonos quirais, dando origem a dezesseis diasteroisômeros. É interessante.
Agora, é difícil especificar qual dos estereoisômeros do quinino desviará a luz polarizada para a direita ou para a esquerda.
Talidomida
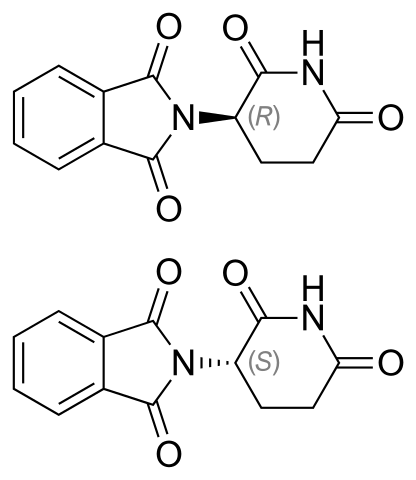 Talaidomide enantimers. Fonte: Vacinationist [Domínio Público]
Talaidomide enantimers. Fonte: Vacinationist [Domínio Público] Os enantiômeros Talidomide são mostrados acima. Ele tem apenas um carbono quiral: aquele que está ligado ao nitrogênio que se junta a ambos os anéis (um da fthalimida e o outro de glutaramida).
No enantiômero r (com propriedades sedativas), o anel ftalimida (aquele à esquerda) é orientado acima do plano; Enquanto estiver em enantiômeros (com propriedades mutagênicas), abaixo.
A porcentagem dos dois não se sabe, qual dos dois desvia a luz para a esquerda ou direita. O que se sabe é que uma mistura 1: 1 ou 50% de ambos os enantiômeros forma a mistura Rankic (±) -talidomida.
Se você deseja comercializar apenas a talidomida como um sedativo hipnótico, é obrigatório enviar sua mistura Rankic para a resolução quiral já mencionada, para que o enantiômero puro seja obtido.
Pode atendê -lo: compostos quaternários: características, treinamento, exemplos1.2-epoxipropano
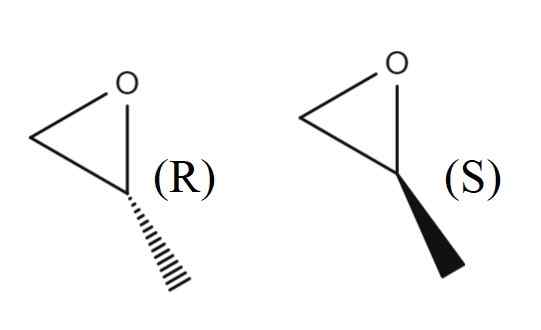 Enantiômeros de 1,2-epoxipropano. Fonte: Gabriel Bolívar.
Enantiômeros de 1,2-epoxipropano. Fonte: Gabriel Bolívar. Na imagem superior, você tem o par de enantiômeros de 1.2-epoxipropano. O enantiômero R desvia a luz polarizada para a direita, enquanto o S a desvia para a esquerda; Ou seja, o primeiro é o (r)-(+)-1,2-epoxipropano e o segundo (s)-(-)-1.2-epoxipropano.
A mistura Rankic deles dois, novamente, em uma proporção de 1: 1 ou 50%, torna -se (±) -1,2 -epoxipropano.
1-feniletilamina
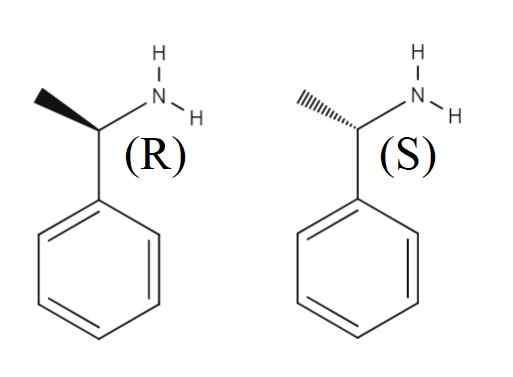
 Enantiômeros de 1-peniletilamina. Fonte: Gabriel Bolívar.
Enantiômeros de 1-peniletilamina. Fonte: Gabriel Bolívar. Superior Outra mistura rankic formada pelos dois enantiômeros de 1-feniletilamina é mostrada. O enantiômero r é (r)-(+)-1-feniletilamina e enantiômero s (s)-(-)-1-feniletilamina; um tem o grupo metil, CHO3, apontando para fora do plano do anel aromático e o outro apontando sob este.
Observe que, quando a configuração é r, às vezes coincide com o fato de que o enantiómero gira a luz polarizada para a direita; No entanto, nem sempre se aplica e não pode ser tomado como regra geral.
Comentário final
Mais importante que a existência ou não das misturas rankic é a resolução quiral do mesmo. Isso se aplica especialmente a compostos com efeitos farmacológicos que dependem desse estereoissoma; Isto é, um enantiômero pode ser benéfico para o paciente, enquanto o outro pode afetá -lo.
É por isso que essas resoluções quirais são recorrers para separar misturas rankic em seus componentes e, assim.
Referências
- Morrison, r. T. e boyd, r, n. (1987). Quimica Organica. 5ª edição. Interamericano Editorial Addison-Wesley.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. Aminas. (10ª edição.). Wiley Plus.
- Steven a. Hardinger. (2017). Glossário ilustrado da química orgânica: mistura racêmica. Departamento de Química e Bioquímica, UCLA. Recuperado de: química.UCLA.Edu
- Nancy Devino. (2019). Mistura racêmica: definição e exemplo. Estudar. Recuperado de: estudo.com
- James Ashenhurst. (2019). Estereoquímica e quiralidade: o que é uma mistura racêmica? Recuperado de: MasterorganicChemistry.com
- João c. Leffingwell. (2003). Quiralidade e bioatividade eu.: Farmacologia. [PDF]. Recuperado de: leffingwell.com

