Metais alcalinéticos
- 1226
- 2
- Alfred Kub
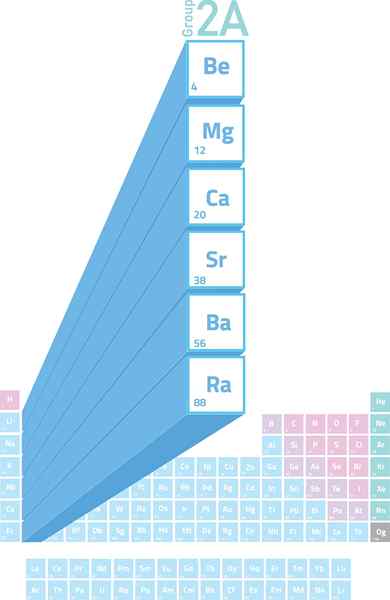
 Localização de metais alcalinotherrosos na tabela periódica
Localização de metais alcalinotherrosos na tabela periódica O que são metais alcalinamente?
O Metais alcalinéticos Eles são os elementos do Grupo 2 (anteriormente chamado Grupo 2a) da Tabela Periódica. Ou seja, eles são formados pelos 6 elementos da segunda coluna da tabela periódica que variam de Beryllium (BE) ao rádio (RA).
Eles são um grupo de elementos metálicos bastante reativos e relativamente comuns. Eles têm apenas dois elétrons de valência localizados em um orbital. Por esse motivo, eles pertencem ao bloqueio da tabela periódica.
O nome "Alkalinoterreo" vem da união de palavras "alcalinas", que é outra maneira de dizer básico e terra, que foi assim que eles foram informados antes dos óxidos. Portanto, metais alcalinotherrosos significam literalmente metais que formam óxidos básicos.
Esses metais têm muitas aplicações que os tornam importantes em nossa sociedade atual, especialmente o magnésio. Essas aplicações são devidas às suas propriedades específicas, que são descritas abaixo.
Propriedades de metais alcalinotherrosos
Eles têm aparência de metal
Todos os metais alcalinotherrosos têm cor de prata com brilho metálico. O radônio também é radioativo, então brilha no escuro emitindo uma luz verde característica.
Eles são pequenos metais densos
Todos os metais alcalinotherrosos são mais densos que a água, mas são menos densos do que a maioria dos outros elementos metálicos na tabela periódica.
As densidades deste grupo variam de 1,54 g/cm3 Para cálcio até 5,5 g/cm3 Para o rádio, que é consideravelmente menor que as densidades de outros metais, como o ferro (7,9 g/cm3), cobre (9,0 g/cm3), chumbo (11,3 g/cm3) e El Mercurio (13,5 g/cm3), por mencionar alguns.
Eles têm pontos de fusão e fervura relativamente baixos
Sendo metais, seus pontos de fusão e ebulição são maiores que os da maioria dos não metais. No entanto, eles são inferiores aos pontos de fusão e ebulição da maioria dos outros metais, com algumas exceções.
Pode atendê -lo: equação de ArrheniusEles têm valência +2
Devido à sua configuração eletrônica, esses metais tendem a perder dois elétrons quando reagem com outros elementos, como não -metais. Por esse motivo, sua única valência é +2.
Eles são relativamente reativos
Os metais alcalinotherrosos são muito mais reativos que os metais como ferro ou cobre, mas são menos reativos que os metais alcalinos (os elementos do grupo 1). Quanto menor o grupo, mais reativo será o metal.
Por exemplo, o berílio (o primeiro do grupo) não reage com a água enquanto os dois seguintes podem reagir com água quente e os últimos podem até reagir com água fria.
Reagir com o ar para formar óxidos básicos
Esses metais tendem a formar óxidos básicos quando reagem com oxigênio do ar. De fato, é por isso que eles são chamados de alcalinos. Esses óxidos, ao se dissolver na água, tornam -se hidróxidos que produzem soluções alcalinas ou básicas.
Aplicações de metal alcalinotro
Na indústria de tecnologia
Alguns dos metais alcalinotherrosos são usados na fabricação de semicondutores. Isso é essencial na construção de circuitos eletrônicos, como aqueles que contêm praticamente todos os aparelhos elétricos modernos, de computadores e telefones celulares, a máquinas de lavar, carros e outros.
Na indústria de alimentos
Cálcio é um nutriente essencial para a vida. Faz parte da estrutura dos ossos e tem outras funções importantes no corpo. Por esse motivo, esse elemento é adicionado como fortificador a muitos alimentos de cereais a laticínios. Além disso, também é usado na fabricação de queijos.
Pode servir a você: Circonium: História, Propriedades, Estrutura, Riscos, UsosNa indústria automobilística
Alguns dos metais alcalinotrosos têm propriedades mecânicas muito boas, o que significa que elas são duras e resistentes. Além disso, eles são resistentes à corrosão, por isso são frequentemente usados na fabricação de rodas de luxo para carros, bem como em outras partes deles.
Na indústria militar
Devido às suas propriedades mecânicas e baixa densidade, metais como magnésio e berílio são usados na construção de aeronaves de combate, satélites e helicópteros.
Além disso, devido às suas propriedades elétricas, eles também são usados na fabricação de diferentes tipos de sensores e sistemas ópticos e eletrônicos que a indústria militar usa para criar armas e sistemas de comunicação.
Os seis metais alcalinos
Existem apenas seis metais alcalinos. Em seguida, há uma breve descrição de cada um deles:
Berílio (BE)
É o elemento número 4 da tabela periódica e o primeiro do grupo de metais alcalinotherrosos. É um metal muito leve e forte, com propriedades únicas que o tornam útil na fabricação de semicondutores.
Magnésio (mg)
O magnésio é um metal prateado relativamente claro, com baixo ponto de fusão e ebulição (em comparação com outros metais). É muito difícil e resistente e é frequentemente usado na fabricação de peças de carro e como um aditivo na preparação de ligas, como certos tipos de aço.
É o segundo alcalino -metal e o elemento número 12 da tabela periódica. Como outros elementos deste grupo, é um nutriente essencial para a vida.
Cálcio (CA)
O cálcio é o quinto elemento mais abundante no córtex da Terra. É encontrado como carbonato de cálcio em muitos minerais e rochas e também é um elemento essencial para a vida devido à sua participação na formação de ossos e sua importância no sistema nervoso.
Pode atendê -lo: cloreto de estrôncio (srcl2)Este metal é o elemento número 20 da tabela periódica, está no quarto período e é o terceiro alcalino -metal.
Strontium (SR)
O elemento número 38 e o quarto metal alcalino é estrôncio. É mais pesado que o cálcio, mas parece muito em termos de suas propriedades químicas e físicas. De fato, o estrôncio pode substituir o cálcio nos ossos.
Isso é especialmente problemático quando nos expojamos ao estrôncio radioativo que ocorre após uma reação nuclear, pois, ao aderir aos ossos, é muito difícil eliminar do corpo e está nos envenenando com radiação pouco a pouco.
Bário (BA)
Este elemento tem número atômico 56 e também possui propriedades bastante semelhantes às de cálcio e estrôncio. É um metal bastante macio e muito reativo que não é de natureza elementar. É um dos metais alcalinotrotrosos com maior caráter metálico.
Rádio (RA)
O último elemento do grupo Alcalinoterreos é o rádio, um metal radioativo (daí o nome) que emite uma luz verde fraca que é fácil de observar no escuro.
Costumava ser usado muito na preparação de pinturas que brilham no escuro, mas depois que o perigo de saúde é descoberto, seu uso foi proibido.

