Menisco (química)
- 2830
- 683
- Gilbert Franecki
 Menisco côncavo e convexo. Fonte: Wikimedia Commons
Menisco côncavo e convexo. Fonte: Wikimedia Commons O que é o menisco (química)?
Ele menisco É a curvatura da superfície de um líquido. É também a superfície livre de um líquido na interface líquido-ar. Os líquidos são caracterizados por ter um volume fixo, sendo incompressivo.
No entanto, a forma dos líquidos varia adotando a forma do recipiente que os contém. Essa característica se deve ao movimento aleatório das moléculas que as formam.
Os líquidos têm a capacidade de fluir, alta densidade e se espalhar rapidamente em outros líquidos com os quais são miscíveis.
Eles ocupam a área mais baixa do recipiente, deixando uma superfície livre não completamente plana no topo. Em algumas circunstâncias, eles podem adotar formas especiais, como gotas, bolhas e bolhas.
As propriedades de líquidos como o ponto de fusão, a pressão de vapor, a viscosidade e o calor da vaporização dependem da intensidade das forças intermoleculares que dão coesão aos líquidos.
No entanto, os líquidos também interagem com o recipiente através das forças de adesão.
O menisco então surge desses fenômenos físicos: a diferença entre as forças de coesão entre partículas líquidas e adesão, o que lhes permite molhar as paredes.
Qual é o menisco?
Como explicado, o menisco é o resultado de vários fenômenos físicos, entre os quais a tensão superficial do líquido também pode ser mencionada.
Forças de coesão
Forças de coesão é o termo físico que explica interações intermoleculares dentro do líquido. No caso da água, as forças de coesão são devidas à interação dipolo-dipolo e pontes de hidrogênio.
Pode atendê -lo: óxido de cloro (iii): propriedades, estrutura, usosA molécula de água é a natureza bipolar. Isso ocorre porque o oxigênio da molécula é eletronegativo porque tem maior avidez devido a elétrons do que hidrogênios, o que determina que o oxigênio permanece com uma carga negativa e os hidrogênios são carregados positivamente.
Há uma atração eletrostática entre a carga negativa de uma molécula de água, localizada em oxigênio, e a carga positiva de outra molécula de água, localizada em hidrogênios.
Essa interação é o que ele sabe como uma interação ou força dipolo-dipolo, que contribui para a coesão fluida.
Forças de adesão
Por outro lado, as moléculas de água podem interagir com paredes de vidro, por carga parcial dos átomos de hidrogênio das moléculas de água que ligam os átomos de oxigênio da superfície do vidro do vidro nos átomos de oxigênio.
Isso constitui a força de adesão entre o líquido e a parede rígida, que coloquialmente significa que o líquido enrola a parede.
Quando uma solução de silicone é colocada na superfície do vidro, a água não impregnam completamente o vidro, mas é formada nisso algumas gotas que são facilmente eliminadas.
Assim, é indicado que, com este tratamento, a força de adesão entre água e vidro é reduzida.
Um caso muito semelhante ocorre quando as mãos são oleosas e, quando as lavá -las com água, gotas muito definidas podem ser vistas na pele em vez da pele umedecida.
Tipos de meniscos
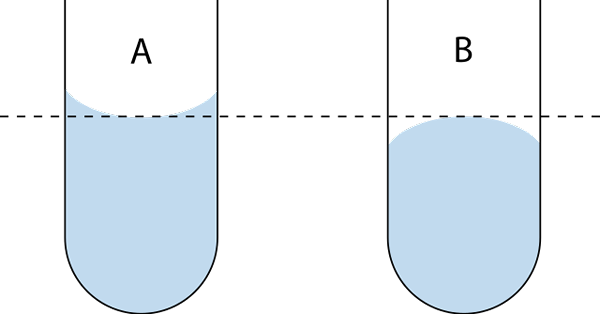
Existem dois tipos de menisco: os côncavos e os convexos. Na imagem superior, o côncavo é o a e o convexo o B. As linhas pontilhadas indicam a descarga correta ao ler uma medida de volume.
Pode atendê -lo: átomo neutroMenisco côncavo
 Medidas côncavas de menisco. Fonte: Wikimedia Commons
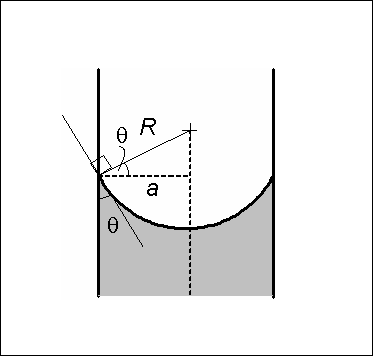
Medidas côncavas de menisco. Fonte: Wikimedia Commons O menisco côncavo é caracterizado em que o ângulo de contato θ que forma a parede do vidro com uma linha tangente para o menisco, que é introduzida no seio do líquido, tem um valor menor que 90º.
Se uma quantidade de líquido for colocada no vidro, ela tende a se espalhar na superfície do vidro.
A presença de um menisc côncavo.
Portanto, o líquido banha ou enruga a parede de vidro, mantendo uma quantidade de líquido e dando ao menisco côncavo. A água é um exemplo de líquido que forma menisco côncavo.
Menisco convexo
No caso do menisco convexo, o ângulo de contato θ tem um valor maior que 90º. Mercúrio é um exemplo de um líquido que forma o menisco convexo. Quando uma gota de mercúrio é colocada em uma superfície de vidro, o ângulo de contato θ tem um valor de 140º.
Observação de um menisc convexo. Dizem que o líquido não molhar o vidro.
As forças superficiais de coesão (líquido líquido) e adesão (líquido-sólido) são responsáveis por muitos fenômenos de interesse biológico, como o caso de tensão superficial e capilaridade.
Tensão superficial
A tensão superficial é uma força de atração líquida exercida nas moléculas de fluido encontradas na superfície e que tende a introduzi -las no líquido.
Pode atendê -lo: elementos diatômicosPortanto, a tensão superficial tende a coes. Em outras palavras, essa força tende a remover a superfície do fluido da parede de vidro.
A tensão superficial tende a diminuir à medida que a temperatura aumenta, por exemplo: a tensão da água da superfície é igual a 0,076 N/m A 0 ° C e 0,059 N/M A 100 ° C.
Enquanto a tensão superficial do mercúrio a 20 ° C é 0,465 N/m. Isso explicaria por que o Mercury Forms Convex Menisco.
Capilaridade
Se o ângulo de contato θ for menor que 90º e o líquido enrola a parede de vidro, o líquido dentro dos capilares de vidro poderá subir até atingir uma condição de equilíbrio.
O peso da coluna líquido é compensado pelo componente vertical da força de coesão devido à tensão superficial. A força de adesão não interveia porque é perpendicular à superfície do tubo.
Esta lei não explica como a água pode subir das raízes para as folhas através dos vasos do xilema.
Na verdade, existem outros fatores envolvidos nesse sentido, por exemplo: quando a água evapora nas folhas, permite que as moléculas de água sejam sugadas na parte superior dos capilares.
Isso permite que outras moléculas no fundo dos capilares ascendam para ocupar o local das moléculas de água evaporadas.
Referências
- Whitten, Davis, Peck e Stanley. Química. Cengage Learning.
- Helmestine, Anne Marie, Ph.D. Como ler menisco em química. Recuperado do pensamento.com

