Funções LDH, determinação, reação, valores normais
- 2954
- 1
- Alfred Kub
O lactato desidrogenase, Ácido lático desidrogenase, dependente dependente de lactato NAD ou simplesmente LDH, é uma enzima pertencente ao grupo oxidorticas encontradas praticamente em todos os tecidos animais, vegetais e em muitos microorganismos, como bactérias, leveduras e arcos.
As enzimas deste tipo são denotadas com o número EC 1.1.1.27 do Comitê de Nomenclatura Enzimática e são responsáveis pela reação que converte lactato em piruvato (por oxidação) e vice -versa (por redução), oxidação ou redução de tincleotídeos de adenina nicotinamida (NAD+ e NADH) no processo conhecido como fermentação lática.
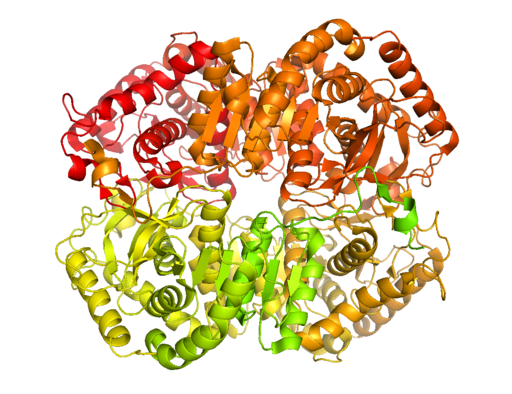
 Estrutura cristalina da lactato desidrogenase B (Fonte: Bcdoye [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] via Wikimedia Commons)
Estrutura cristalina da lactato desidrogenase B (Fonte: Bcdoye [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] via Wikimedia Commons) Ao contrário da fermentação alcoólica, que ocorre apenas em alguns microorganismos, como leveduras e uso.
Esta importante enzima para o metabolismo celular foi cristalizada a partir do músculo de rato esquelético na década de 1940 e, até o momento, os mais bem caracterizados são os do músculo esquelético e o tecido cardíaco em mamíferos.
Em animais “superiores”, a enzima usa o isômero L lactato (L-lactato) para a produção de piruvato, mas alguns animais e bactérias “inferiores” produzem d-lactato a partir do piruvato obtido por glicólise.
O lactato desidrogenase é geralmente expresso principalmente em tecidos ou células sob condições anaeróbicas (baixa irrigação no sangue) que, em humanos, por exemplo, podem caracterizar condições patológicas como câncer, fígado ou condições cardíacas.
No entanto, a conversão do piruvato em lactato é típica dos músculos durante o exercício e a córnea do olho, que é pouco oxigenada.
[TOC]
Funções
Lactato desidrogenase atende várias funções em inúmeras rotas metabólicas. É o centro do delicado equilíbrio entre as rotas catabólicas e anabólicas dos carboidratos.
Durante a glicólise aeróbica, o piruvato (o último produto da rota por si só) Pode ser usado como substrato da piruvato de complexo enzimático desidrogenase, por quem é descarboxilada, libertando moléculas de acetil-coa que são usadas a jusante, metabolicamente falando, no ciclo Krebs.
Na glicólise anaeróbica, pelo contrário, a última etapa da glicólise produz piruvato, mas isso é usado pela lactato desidrogenase para produzir lactato e NAD+, que restaura o NAD+ que foi usado durante a reação catalisada por gliceraldeído 3-fosfato desidrogenase.
Como durante a anaerobiose a principal fonte de produção de energia na forma de ATP é a glicólise, a lactato desidrogenase tem um papel fundamental na reoxidação do NADH produzido nas etapas anteriores da rota glicolítica, essencial para a operação de outras enzimas relacionadas.
Pode atendê -lo: tubulinaA lactato desidrogenase também está envolvida na glicogênese que ocorre em tecidos que convertem lactato em glicogênio e, em alguns tecidos aeróbicos, como o coração, o lactato é um combustível que é reoxido para produzir energia e reduzir a energia na forma de ATP e NAD+, respectivamente.
Características e estrutura
Existem múltiplas formas moleculares de lactato desidrogenase na natureza. Somente em animais, foi determinado que existem cinco atividades lactato desidrogenase, todas tetraméricas e essencialmente compostas por dois tipos de cadeias polipeptídicas conhecidas como subunidades H e M (sendo capazes de ser homo- ou heterotramérrica).
A forma H é tipicamente em tecido cardíaco, enquanto a forma M foi detectada no músculo esquelético. Ambas as cadeias diferem entre si em termos de abundância, composição de aminoácidos, propriedades cinéticas e propriedades estruturais.
As formas H e M são o produto translacional de diferentes genes, possivelmente localizados em diferentes cromossomos, e que também estão sob o controle ou regulação de diferentes genes. A forma H é predominante nos tecidos com metabolismo aeróbico e a forma M em tecidos anaeróbicos.
Outro tipo de nomenclatura usa letras A, B e C para os diferentes tipos de enzimas em mamíferos e pássaros. Assim, o lactato muscular desidrogenase é conhecido como4, cardíaco como b4 e um terceiro é chamado C4, que é específico para os testículos.
A expressão dessas isoenzimas é regulada tanto em uma forma de dependente do desenvolvimento quanto dependente do tecido.
A enzima foi isolada de diferentes fontes animais e foi determinado que sua estrutura tetramérica tem um peso molecular médio de cerca de 140 kDa e que o local da União para NADH ou NAD+ Consiste em uma folha de β pendurada composta por seis cadeias e 4 hélices alfa.
Determinação
Por espectrofotometria
Atividade de lactato desidrogenase de origem animal tem certeza espectrofotometricamente Em vitro Através das medições de mudança de coloração, graças ao processo de oxiderdução que ocorre durante a reação de conversão de piruvato de lactato.
As medições são feitas a 340 nm com um espectrofotômetro e a taxa de diminuição da densidade óptica devido à oxidação ou "desaparecimento" de NADH é determinada, que é convertida para NAD+.
Isto é, a reação determinada é a seguinte:
Piruvato + nadh + h+ → Lactato + NAD+
A medição enzimática deve ser realizada em condições ideais de pH e concentração de substratos para a enzima, de modo que o risco de subestimar a quantidade presente nas amostras devido ao déficit de substrato ou por condições extremas de acidez ou basicidade não esteja executada.
Por imuno -histoquímica
Outro método, talvez um pouco mais moderno, para a determinação da presença de lactato desidrogenase tem a ver com o uso de ferramentas imunológicas, isto é, com o uso de anticorpos.
Pode servir você: homologia (biologia)Esses métodos aproveitam a afinidade entre a união de um antígeno com um anticorpo gerado especificamente contra ele e são muito úteis para a rápida determinação da presença ou ausência de enzimas como LDH em um determinado tecido.
Dependendo do objetivo, os anticorpos utilizados devem ser específicos para a detecção de qualquer uma das isoenzimas ou para qualquer proteína com atividade de lactato desidrogenase.
Por que determinar a desidrogenase lactato?
A determinação dessa enzima é realizada com propósitos diferentes, mas principalmente para o diagnóstico clínico de algumas condições, incluindo infarto do miocárdio e câncer.
No nível celular, a liberação de lactato de desidrogenase tem sido considerada um dos parâmetros para determinar a ocorrência de processos necróticos ou apoptóticos, uma vez que a membrana plasmática se torna permeável.
Os produtos da reação que o catalisado também podem ser determinados em um tecido para determinar se um metabolismo anaeróbico predomina por algum motivo especial.
Reação
Como comentou inicialmente, a enzima lactato desidrogenase, cujo nome sistemático é (S) -Lactato: nad+ desidrogenase, conversão de lactato catalisado em um piruvato+ dependente, ou vice -versa, que ocorre graças à transferência de um íon hidreto (h-) Do piruvato ao lactato ou de NADH a piruvato oxidado.
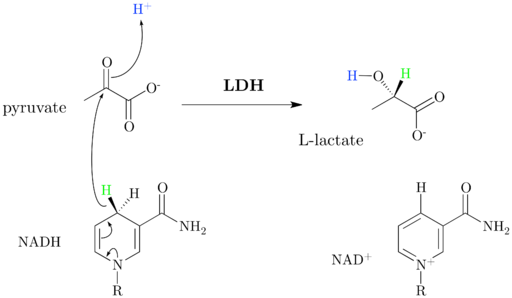 Mecanismo de esquema e reação do lactato desidrogenase (fonte: jazzlw [cc by-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons)
Mecanismo de esquema e reação do lactato desidrogenase (fonte: jazzlw [cc by-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons) O nad+ Possui uma unidade ADP e outro grupo nucleótico derivado do ácido nicotínico, também chamado de niacina ou vitamina B3, E essa coenzima participa de múltiplas reações de grande importância biológica.
É importante destacar que o equilíbrio nessa reação é deslocado para o lado correspondente ao lactato e foi demonstrado que a enzima também é capaz de oxidar outros ácidos (S) -2 -hidroximonocarboxílico e uso, embora com menos eficiência, NADP+ como substrato.
Dependendo da região do corpo que é considerada e, ao mesmo tempo, suas características metabólicas em relação à presença ou ausência de oxigênio, os tecidos produzem diferentes quantidades de lactato, o produto da reação catalisado pelo LDH.
Se, por exemplo, um glóbulo vermelho (eritrócito) que não possui mitocôndrias que possam metabolizar o piruvato produzido durante a glicólise para CO2 E água, então pode -se dizer que essas são as principais células produtoras de lactato no corpo humano, uma vez que todo piruvato é convertido em lactato pela ação da desidrogenase lactato.
Por outro lado, se as células e células do fígado do músculo esquelético forem consideradas, elas são responsáveis pela produção de uma quantidade mínima de lactato, tendo em vista o fato de que isso é rapidamente metabolizado.
Pode atendê -lo: Sabouraud Agar: o que é, fundamento, preparação, usaValores normais
A concentração de lactato desidrogenase no soro sanguíneo é o produto da expressão de várias isoenzimas no fígado, coração, músculo esquelético, eritrócitos e tumores, entre outros.
No soro sanguíneo, as faixas normais de atividade do lactato desidrogenase estão entre 260 e 850 U/ml (unidades por mililitro), com um valor médio de 470 ± 130 U/ml. Enquanto isso, os hemoralizados no sangue têm uma atividade de LDH que varia entre 16.000 e 67.000 u/ml, que é equivalente a uma média de 34.000 ± 12.000 u/ml.
O que significa ter um LDH alto?
A quantificação da concentração de lactato desidrogenase no soro do sangue tem um valor importante no diagnóstico de algum coração, fígado, doenças sanguíneas e até câncer.
Altos números de atividade de LDH foram encontrados em pacientes com infartos do miocárdio (experimental e clínica), bem como em pacientes cancerígenos, especificamente em mulheres com câncer endometrial, ovários, mama e útero.
Dependendo da isoenzima particular que está em "excesso" ou em alta concentração, a quantificação das isoenzimas do lactato desidrogenase é usada por muitos médicos que tratam a determinação de lesões nos tecidos (graves ou crônicos).
Referências
- Bergmeyer, h., Dobrado, e., & Hess, b. (1961). Desidrogenase lática. Métodos de análise enzimática. Seelag Chemie, GmbH.
- Chung, f., Tsujubo, h., Bhattacharyya, u., Sharief, f., & Li, S. (1985). Organização genômica do gene de lactato humano desidrogenase-A. Jornal Bioquímico, 231, 537-541.
- Becker, d. (2003). Acidose lática. Intensivo Med, 29, 699-702.
- Mesmo, j., & Kaplan, n. (1973). Desidrogenses de lactato: estrutura e função. Em Avanços em enzimologia e áreas relacionadas de biologia molecular (pp. 61-133).
- Fox, s. Yo. (2006). Fisiologia humana (9ª ed.). Nova York, EUA: McGraw-Hill Press.
- Huijgen, h., Sanders, g. T. B., Koster, r. C., Vreeken, J., & Bossuyt, P. M. M. (1997). O valor clínico da lactato desidrogenase no soro: uma revisão quantitativa. Eur J Clin Chem Clin Biochem, 35(8), 569-579.
- Comitê de Nomenclatura da União Internacional de Bioquímica e Biologia Molecular (NC-IBMB). (2019). Recuperado de www.Qmul.AC.UK/SBCS/iubmb/enzima/índice.Html
- Rawn, j. D. (1998). Bioquímica. Burlington, Massachusetts: Neil Patterson Publishers.
- USateGui-Gomez, m., Wicks, r. C., & Warshaw, M. (1979). Determinação imunoquímica da isoenzima do coração da lactato desidrogenase (LDH1) no soro humano. Clin Chem, 25(5), 729-734.
- Wróblewski, f., & LADUE, J. S. (1955). Atividade lática de degrogenase no sangue. Biologia Experimental e Medicina, 90, 210-215.
- « Características do Páramo, Tipos, Flora, Fauna, Exemplos
- Apolipoproteína e características, funções, doenças »

