Joseph Thomson

- 3203
- 627
- Alfred Kub
 J.J. Thomson
J.J. Thomson Joseph John Thomson (1856-1940) Era um químico britânico alto. Ele ganhou o Prêmio Nobel de Física em 1906.
Ele nasceu em Cheetam Hill, um distrito de Manchester, Inglaterra, em 18 de dezembro de 1856. Também conhecido como "J.J."Thomson estudou engenharia no Owens College, atualmente parte da Universidade de Manchester, e depois matemática em Cambridge.
Em 1890, J.J. Thomson casou -se com Rose Elizabeth Paget, filha do doutor Sir Edward George Paget, com quem teve dois filhos: uma garota, chamada Joan Paget Thomson, e uma criança, George Paget Thomson.
Este último se tornaria um cientista famoso, obtendo em 1937 um Prêmio Nobel de Física por seu trabalho com elétrons.
Desde tenra idade, Thomson concentrou seus estudos na estrutura dos átomos, descobrindo assim a existência de elétrons e isótopos, entre muitas outras contribuições.
Em 1906, Thomson recebeu o Prêmio Nobel de Física, "em reconhecimento ao grande mérito de sua pesquisa teórica e experimental sobre a condução de eletricidade através de gases", conforme estabelecido pelo júri no veredicto do prêmio acima mencionado.
Em 1908, ele foi nomeado Knight pela Coroa Britânica e atuou como Professor Honorário de Física em Cambridge e The Royal Institute, Londres.
Ele morreu em 30 de agosto de 1940 aos 83 anos, na cidade de Cambridge, Inglaterra. O físico foi enterrado na Abadia de Westminster, perto da tumba de Sir Isaac Newton.
Contribuições de Joseph Thomson para a ciência e a química
Descoberta de elétrons
Em 1897, J.J. Thomson descobriu uma nova partícula de luz que o hidrogênio, que foi batizado "elétron".
Pode servir a você: Determinação de cinzas: métodos e exemplosO hidrogênio foi considerado uma unidade de medição de peso atômico. Até aquele momento, o átomo era a menor divisão da matéria.
Nesse sentido, Thomson foi o primeiro a descobrir as partículas subatômicas corpusculares carregadas negativamente.
Modelo Atômico de Thomson
O modelo atômico de Thomson foi a estrutura que o físico inglês atribuiu aos átomos. Para o cientista, os átomos eram uma esfera de carga positiva.
Foram incorporados elétrons distribuídos negativamente nessa nuvem de carga positiva, ou seja, neutralizando a carga positiva da massa do átomo.
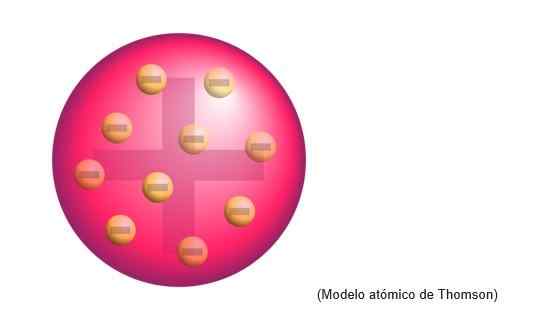
Este novo modelo substitui o elaborado por Dalton e mais tarde será refutado por Rutherford, discípulo de Thomson nos Laboratórios Cavendish de Cambridge.
Separação de átomos
Thomson usou raios positivos ou anódicos para separar átomos de diferentes massa. Este método permitiu que ele calcule a eletricidade transportada por cada átomo e o número de moléculas por centímetro cúbico.
Ser capaz de dividir os átomos de diferentes massa e carga, o físico descobriu a existência de isótopos. Também dessa maneira, com seu estudo de raios positivos, ele produziu um grande avanço em direção à espectrometria de massa.
Descoberta de isótopos
J.J. Thomson descobriu que os íons neon tinham massas diferentes, ou seja, peso atômico diferente. Foi assim que Thomson mostrou que o néon tem dois subtipos de isótopos, o neon-20 e o neon-22.
Os isótopos, estudados até hoje, são átomos do mesmo elemento, mas seus núcleos têm um número de massa diferente, pois são compostos de diferentes quantidades de nêutrons em seu centro.
Experimentos com raios de cátodo
Os raios catódicos são correntes de elétrons em tubos de vácuo, ou seja, tubos de vidro com dois eletrodos, um positivo e um negativo.
Pode servir a você: hidróxido de cromo: estrutura, propriedades, síntese, usosQuando o eletrodo negativo é aquecido, também chamado de cátodo, emite radiação que é direcionada para o eletrodo positivo, ou ânodo, em uma linha reta, se nenhum campo magnético ocorrer nessa rota.
Se as paredes de vidro do tubo estiverem cobertas com material fluorescente, o golpe dos catodos contra essa camada produz a projeção da luz.
Thomson estudou o comportamento dos raios do cátodo e chegou às conclusões de que os raios se espalharam em linha reta.
Ele também concluiu que esses raios poderiam ser desviados de sua trajetória pela presença de um ímã, isto é, de um campo magnético. Além disso, os raios poderiam mover as lâminas com a força dos elétrons circulando, demonstrando assim que os elétrons tinham massa.
J.J. Thomson experimentou o gás dentro do tubo do raio catódico, mas o comportamento dos elétrons não variava. Da mesma forma, os raios do cátodo aqueceram os objetos que interpõem na estrada entre os eletrodos.
Em conclusão, Thomson mostrou que os raios de cátodo tinham efeitos leves, mecânicos, químicos e térmicos.
Os tubos de raios catódicos e suas propriedades leves foram transcendentais para a invenção subsequente da televisão de tubo (CTR) e câmeras de vídeo.
Espectrômetro de massa
J.J. Thomson criou uma primeira abordagem para Espectrômetro de massa. Esta ferramenta permitiu o estudo do cientista.
Com esta investigação, ele concluiu que os raios do cátodo eram compostos de corpúsculos de carga negativa, que estão dentro dos átomos, postulando a divisibilidade do átomo e dando origem à figura do elétron.
Pode atendê -lo: ácido butírico: fórmula, propriedades, riscos e usosAlém disso, os avanços na espectrometria de massa continuaram até hoje, evoluindo em diferentes métodos para separar os elétrons dos átomos.
Além disso, Thomson foi o primeiro a sugerir O Guia da Primeira Onda em 1893. Este experimento consistiu em spread.
Guias de ondas seriam amplamente utilizados no futuro, ainda hoje, com transmissão de dados e fibra óptica.
O legado de Thomson
O Thomson (TH) foi estabelecido como uma unidade de carga de massa em espectrometria de massa, proposta por cozinheiros e produtos químicos de rockwood, em homenagem a Thomson.
Esta técnica permite determinar a distribuição das moléculas de uma substância de acordo com sua massa e, reconheça por isso, que estão presentes em uma amostra de matéria.
Thomson Fórmula (Th):
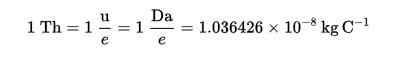
Obras excelentes
- A deserto da eletricidade através de gases, eletricidade através de gases (1900).
- A teoria corpuscular da matéria, o elétron em química e lembranças e reflexões (1907).
- Além do Electron (1928).
Referências
- Nobel Media AB (2014). J. Thomson - Biográfico. Premio Nobel.org. Premio Nobel.org.
- Thomson, Joseph J., Eletricidade através do comportamento dos gases. Cambridge, University Press, 1903.
- Menchaca Rocha, Arturo. O charme discreto de partículas elementares.
- Christen, Hans Rudolf, Fundamentos da Química Geral e Inorgânica, Volume 1. Barcelona Espanha. Edições reverté s.PARA., 1986.
- Arzani, Aurora Cortina, Química Geral Elementar. México, editorial de Porrúa, 1967.
- R. G. Cozinheiros, a. eu. Rockwood. Rapid Commun. Espectrom de massa. 5, 93 (1991).

