Características de isoleucina, funções, biossíntese, comida
- 4463
- 112
- Dennis Heidenreich
O isoleucina (Ile, i) é um dos 22 aminoácidos presentes na natureza como parte das proteínas. Em vista do fato de que o corpo humano, como o de alguns outros mamíferos, não pode sintetizá -lo, a isoleucina está entre os 9 aminoácidos essenciais que devem ser obtidos com a dieta.
Este aminoácido foi isolado pela primeira vez em 1903 pelo cientista F. Ehrlich dos constituintes de nitrogênio da beterraba ou melaço de beterraba. Posteriormente, o mesmo autor separou a isoleucina dos produtos de decomposição da fibrina e outras proteínas.
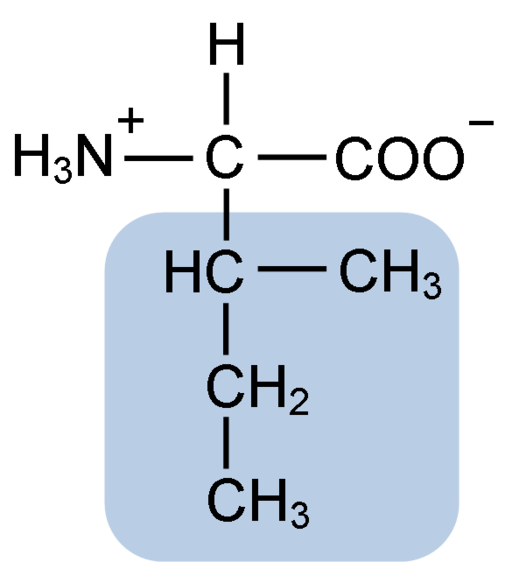
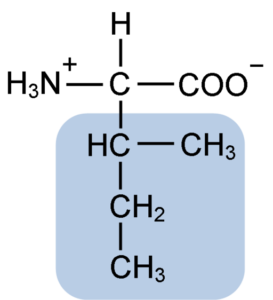 Estrutura química do aminoácido isoleucina (fonte: clavecina [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons)
Estrutura química do aminoácido isoleucina (fonte: clavecina [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons) É um aminoácido não polar presente em grande parte das proteínas celulares dos organismos vivos, além disso, faz parte dos aminoácidos da cadeia ramificada do BCAAS (do inglês BRanched CHain PARAMeu não PARACIDS), Juntamente com Leucina e Valina.
Ele tem funções no estabelecimento da estrutura terciária de muitas proteínas e, além disso, participa da formação de vários precursores metabólicos relacionados ao metabolismo da energia celular.
[TOC]
Caracteristicas
A isoleucina é classificada dentro do grupo de aminoácidos não polares com grupos ou cadeias de natureza auditiva, ou seja, com cadeias de hidrocarbonetos de hidrocarbonetos.
Devido a essa característica, os aminoácidos desse grupo como alanina, valina e leucina tendem a permanecer próximos um do outro, o que contribui para a estabilização de proteínas que fazem parte por meio de interações hidrofóbicas.
Este aminoácido não polar pesa aproximadamente 131 g/mol e está presente em proteínas em uma proporção próxima a 6%, geralmente "enterrada" no centro delas (graças às suas qualidades hidrofóbicas).
Estrutura
A isoleucina é um α-aminoácido que, como os outros aminoácidos, possui um átomo de carbono central chamado α (que é quiral), ao qual quatro grupos diferentes são unidos: um átomo de hidrogênio, um grupo amino (-NH2), A Grupo Carboxil (-coh) e uma corrente lateral ou R Grupo.
O grupo isoleucina R consiste em um hidrocarboneto simples de 4 átomos de carbono (-CH3-CH2-CH (CH3)) em cuja cadeia também há um átomo de carbono quiral.
Devido a essa característica, a isoleucina tem quatro maneiras possíveis: duas delas são os isômeros ópticos conhecidos como L-isoleucina e D-isoleucina e os outros dois são diateroisômeros de L-isoleucina. A forma predominante nas proteínas é L-isoleucina.
A fórmula molecular da isoleucina é C6H13NO2 e seu nome químico é α-amino-β-metil-β-etilpropiônico ou 2-amino-3-metil pentatônico ácido ou ácido ácido ácido.
Funções
A isoleucina tem múltiplas funções fisiológicas em animais, incluindo o
- Cicatrização de feridas
- Desintoxicação por resíduos de nitrogênio
- Estimulação de funções imunes e
- Promoção da secreção de diferentes hormônios.
É considerado um aminoácido glicogênico, pois serve como uma molécula precursora para a síntese de intermediários do ciclo ácido cítrico (ciclo Krebs) que posteriormente contribuem para a formação de glicose no fígado.
Por esse motivo, acredita -se que a isoleucina participe da regulação dos níveis de glicose plasmática, o que tem implicações importantes do ponto de vista da energia do corpo.
A isoleucina contribui para as rotas de síntese de glutamina e alanina, trabalhando em favor do equilíbrio entre aminoácidos de cadeia ramificada.
No campo clínico, alguns autores apontam que um aumento nas concentrações de isoleucina, leucina, tirosina e valina pode ser marcadores característicos das células afetadas pelo tumor, seguidas por um aumento nos níveis de glutamina.
Outras funções
Diferentes pesquisas científicas mostraram que a isoleucina é necessária para a síntese de hemoglobina, a proteína responsável pelo transporte de oxigênio no sangue de muitos animais.
Além disso, este aminoácido ativa a entrada de nutrientes nas células; Alguns estudos revelam que, durante o jejum prolongado, é capaz de substituir a glicose como fonte de energia e, além disso, é um aminoácido cetogênico.
Pode atendê -lo: Linha do tempo da biologiaAminoácidos cetogênicos são aqueles cujos esqueletos de carbono podem ser armazenados, como ácidos graxos ou carboidratos, para que trabalhem na reserva de energia.
A isoleucina e outros aminoácidos de cadeia ramificada (além de fatores de crescimento e condições ambientais) funcionam na ativação da via de sinalização branca ou alvo da rapamicina, mTOR (do inglês mTananístico TArget qualquerF RApamicina).
Esta rota é uma importante rota de sinalização nos eucariotos capazes de controlar o crescimento e o metabolismo celular, bem como os eventos de síntese de proteínas e autofagia. Além disso, controla o progresso do envelhecimento e algumas patologias como câncer ou diabetes.
Biossíntese
Os seres humanos e outros animais são incapazes de sintetizar a isoleucina, mas isso faz parte das proteínas celulares graças à sua aquisição da comida que consumimos diariamente.
Plantas, fungos e a maioria dos microorganismos são capazes de sintetizar esse aminoácido de rotas um tanto complexas que geralmente são interconectadas com as de outros aminoácidos também considerados essenciais para o homem.
Existem, por exemplo, maneiras para a produção de isoleucina, lisina, metionina e treonina do aspartato.
Nas bactérias, especificamente, a isoleucina é produzida a partir do aminoácido da treonina, através do piruvato, através de uma rota que implica a condensação de 2 dos carbonos piruvatos com uma molécula de α-ectobutirato que deriva da treonina.
A reação começa com a ação da enzima desidratase, que catalisa a desidratação da treonina para produzir α-ecotobutirato e amônio (NH3). Posteriormente, as mesmas enzimas que participam da biossíntese da valina contribuem para as etapas de
- Transaminação
- Descarboxilação oxidativa dos cetoácidos correspondentes e
- Desidrogenação.
Nesse tipo de microorganismos, a síntese de aminoácidos como lisina, metionina, treonina e isoleucina é muito coordenada e regulada, especialmente por feedback negativo, onde os produtos de reações inibem a atividade das enzimas envolvidas.
A pesar de que la isoleucina, al igual que la leucina y la valina, son aminoácidos esenciales para el hombre, las enzimas aminotransferasas presentes en los tejidos corporales pueden inter-convertirlos reversiblemente a sus α-cetoácidos correspondientes, que pueden, eventualmente, reemplazarlos en Dieta.
Degradação
Como grande parte dos aminoácidos conhecidos na natureza, a isoleucina pode ser degradada para formar intermediários de diferentes rotas metabólicas, entre as quais o ciclo Krebs (que fornece a maior quantidade de coenzimas que opera para produção de energia ou para biossíntese de outros compostos ).
Tanto a isoleucina quanto o triptofano, lisina, fenilalanina, tirosina, treonina e leucina podem ser usados para produzir acetil-CoA, um intermediário metabólico chave para reações celulares múltiplas.
Ao contrário de outros aminoácidos, os aminoácidos de cadeia ramificada (leucina, isoleucina e valina) não são degradados no fígado, mas são oxidados como combustíveis no músculo, cérebro, rins e tecido adiposo.
Esses órgãos e tecidos podem usar esses aminoácidos graças à presença de uma enzima aminotransferase capaz de agir nos três e produzir seu aminoácido correspondente α-zo.
Uma vez produzidos esses derivados aminoácidos oxidados, o complexo enzimático α-zo-cetoacídeo catalisa a descarboxilação oxidativa deles, onde libera uma molécula de dióxido de carbono (CO2) e produz um derivado de acil-coa de aminoácidos em questão.
Patologias relacionadas ao metabolismo da isoleucina
Defeitos no metabolismo da isoleucina e outros aminoácidos podem causar diversidade de patologias estranhas e complexas, como a doença ""Urina de xarope de bordo”(Urina com xarope Arce) ou cetoacidúria ramificada.
Como o nome indica, esta doença é caracterizada pelo aroma distinto da urina de pacientes que sofrem dela, além de vomitar, convulsões, retardo mental e morte prematura.
Tem a fazer, especificamente, com erros no complexo enzimático α----quetoacid desidrogenase, de modo que os aminoácidos de cadeia ramificados, como a isoleucina e seus derivados oxidados, são excretados na urina.
Pode atendê -lo: Tafonomia: História, Preservação e Alteração FóssilJuntos, as patologias relacionadas ao catabolismo de aminoácidos de cadeia ramificada, como a isoleucina, são conhecidos como acidúrias orgânicas, embora aqueles que estão diretamente relacionados a este aminoácido sejam bastante raros.
Alimentos ricos em isoleucina
Este aminoácido é abundante nos tecidos musculares dos animais, de modo que carnes de origem animal, como vaca, carne de porco, peixe e outros semelhantes, como cordeiro, frango, peru, veado, entre outros, são ricos na mesma.
Também é encontrado nos laticínios e seus derivados, como o queijo. Está em ovos e também em diferentes tipos de sementes e nozes, como uma parte essencial das proteínas que as constituem.
É abundante em soja e ervilhas, bem como nos extratos de leveduras usadas com vários fins alimentares.
Os níveis plasmáticos de isoleucina para um ser humano adulto estão entre 30 e 108 μmol/L, para crianças e jovens entre os 2 e 18 anos de idade estão entre 22 e 107 μmol/L e para bebês entre 0 e 2 anos entre 26 e 86 μmol/L.
Esses dados sugerem que o consumo de alimentos ricos neste e em outros aminoácidos relacionados é necessário para a manutenção de muitas das funções fisiológicas do organismo, uma vez que os seres humanos são incapazes de sintetizá -lo de Novo.
Benefícios da sua ingestão
Suplementos nutricionais com isoleucina geralmente contêm outros aminoácidos essenciais de cadeia ramificada, como valina ou leucina ou outro.
Entre os exemplos mais comuns de consumo de isoleucina estão os suplementos nutricionais usados pelos atletas para aumentar a porcentagem de massa muscular ou síntese de proteínas. No entanto, a base científica sobre a qual essas práticas são suportadas são constantemente discutidas e seus resultados não são totalmente garantidos.
A isoleucina, no entanto, é usada para neutralizar os efeitos metabólicos da deficiência de vitamina (pelagra) característica de pacientes com dietas ricas de sorgo e milho, que são alimentos com alto teor de leucina, que podem afetar o metabolismo do triptofano e do ácido nicotínico em humanos.
Os efeitos do pelagra em ratos experimentais, por exemplo, envolvem atrasos no crescimento, que são superados com a suplementação de isoleucina.
- Na indústria de produção animal
Na área de produção animal, aminoácidos como lisina, treonina, metionina e isoleucina têm sido usados em testes piloto para alimentação de porcos que crescem em condições controladas.
A isoleucina, em particular, parece ter efeitos na assimilação de nitrogênio, embora não contribua para o ganho de peso desses animais de fazenda.
- Em algumas condições clínicas
Algumas publicações sugerem que a isoleucina é capaz de reduzir os níveis de glicose plasmática, de modo que sua ingestão é recomendada em pacientes que sofrem de distúrbios como diabetes ou baixas taxas de produção de insulina.
Infecções virais
A suplementação de isooleucina se mostrou útil em pacientes infectados com rotavírus que causam doenças como gastroenterite e diarréia em crianças pequenas e outros animais jovens.
Estudos recentes concluem que o consumo desse aminoácido por animais experimentais com as características acima mencionadas (infectadas com rotavírus) ajuda no crescimento e no desempenho do sistema imunológico inato, graças à ativação de rotas de sinalização de PRR ou receptores com o reconhecimento do reconhecimento de reconhecimento de Padrões.
Distúrbios de deficiência
A isoleucina de deficiência pode ter problemas na visão, pele (como dermatite) e intestinos (evidente como diarréia e outras manifestações gastrointestinais)))).
Em vista do fato de ser um aminoácido essencial para a formação e síntese de hemoglobina, bem como para a regeneração de eritrócitos (células sanguíneas), deficiências graves na isoleucina podem ter sérias conseqüências fisiológicas, especialmente relacionadas a anemias e outras hematológicas doenças.
Pode atendê -lo: consumidores terciáriosIsso foi demonstrado experimentalmente em roedores "normais" aos quais dietas pobres foram fornecidas nesta isoleucina, que termina com o desenvolvimento de importantes pinturas anêmicas.
No entanto, a isoleucina participa da formação de hemoglobina apenas em bebês, uma vez que a proteína do ser humano adulto não possui quantidades importantes desse aminoácido; Isso significa que a falta de isoleucina é mais evidente durante os primeiros estágios de desenvolvimento.
Referências
- Aders Plimmer, r. (1908). A constituição química das proteínas. deixei. Londres, Reino Unido: Longmans, Green e Co.
- Aders Plimmer, r. (1908). A constituição química das proteínas. parte II. Londres, Reino Unido: Longmans, Green e Co.
- Barret, g., & Elmore, D. (2004). Aminoácidos e peptídeos. Cambridge: Cambridge University Press.
- Blau, n., Duran, m., Blaskovics, m., & Gibson, K. (mil novecentos e noventa e seis). Guia do médico para o diagnóstico laboratório de doenças metabólicas (2ª ed.).
- Bradford, h. (1931). A história da descoberta dos aminoácidos. Ii. Uma revisão dos aminoácidos descritos desde 1931 como componentes de proteínas nativas. Avanços na química de proteínas, 81-171.
- Campos-Ferraz, p. eu., Bozza, t., NICASTRO, h., E barco, para. H. (2013). Efeitos distintos da leucina ou uma mistura do amininoácido de cadeia ramificada (leucina, isoleucina e valina) suplementação na resistência à fadiga e degradação muscular e de glicogênio hepático, em ratos treinados ratos. Nutrição, 29(11-12), 1388-1394.
- Champe, p., & Harvey, r. (2003). Aminoácidos aminoácidos. Em Revisões ilustradas de Lippincott: Bioquímica (3ª ed., pp. 1-12). Lippincott.
- Chandran, k., & Damodaran, M. (1951). Aminoácidos e proteínas na formação de hemoglobina 2. Isoleucina. Jornal Bioquímico, 49, 393-398.
- Chung, a. S., & Feemes, r. M. (1974). Lisina, treonina, metionina e suplementação de isoleucina da cevada do rio Peace para porcos em crescimento. Cachorro. J. Anim. Sci., 436, 429-436.
- Dejong, c., Meijerink, w., Van Berlo, c., Deutz, n., & Stoeters, P. (mil novecentos e noventa e seis). Desdomed Plasma Isoleucine Concenters após hemorragem gastrointencial superior em humanos. INTESTINO, 39, 13-17.
- Edsall, J. (1960). Amininoácidos, proteínas e bioquímica de câncer (Vol. 241). Londres: Academic Press, Inc.
- Enciclopédia Britannica. (2012). Recuperado em 30 de agosto de 2019, de https: // www.Britannica.com/ciência/isoleucina
- Gelfand, r., Hendler, r., & Sherwin, R. (1979). Carboidratos alimentares e metabolismo da proteína ingerida. A lancet, 65-68.
- Hudson, b. (1992). Bioquímica de proteínas alimentares. Springer-Science+Business Media, B.V.
- KERN, i., Vockley, J., & Gibson, K. M. (2014). Distúrbios da leucina, isoleucina e metabolismo valino. Pousada. Blau (Ed.), Guia do médico para o diagnóstico, tratamento e acompanhamento de doenças metabólicas herdadas (pp. 103-141).
- Korman, s. H. (2006). Erros inatos de degradação da isoleucina: uma revisão. Genética molecular e metabolismo, 89(4), 289-299.
- Krishnaswamy, k., & Gpalan, C. (1971). Efeito da isoleucina na pele e eletroencefalograma em Pellagra. A lancet, 1167-1169.
- Martin, r. E., & Kirk, K. (2007). Transporte da isoleucina nutriente essencial em eritrócitos humanos infectados com a malária parasita Plasmodium falciparum. Sangue, 109(5), 2217-2224.
- Centro Nacional de Informações sobre Biotecnologia. Banco de dados PubChem. L-isoleucina, CID = 6306, https: // pubchem.NCBI.Nlm.NIH.Gov/Compund/L-isoleucine (acessado em agosto. 31, 2019)
- Nuttall, f. Q., Schweim, k., & Gannon, M. C. (2008). Efeito da isoleucina administrada por via oral com e sem glicose nas concentrações de insulina, glucagon e glicose em indivíduos não diabéticos. O E-Journal Europeu de Nutrição Clínica e Metabolismo, 3(4), 152-158.
- Van Berlo, c. eu. H., Van de bogaard, para. E. J. M., Van der Heijden, M. PARA. H., Van eijk, h. M. H., Janssen, m. PARA., Bost, m. C. F., & Stoeters, P. B. (1989). É uma libertação de amônia incrivelmente depois de sangrar no trato digestivo, a adição de completa ausência de isoleucina na hemoglobina? Um estudo em porcos. Hepatologia, 10(3), 315-323.
- Vickery, h. B., & Schmidt, C. eu. PARA. (1931). A história da descoberta dos aminoácidos. Revisões químicas, 9(2), 169-318.
- Wolfe, r. R. (2017). Aminas de cadeia ramificada e síntese de proteínas musculares em humanos: mito ou realidade? Jornal da Sociedade Internacional de Nutrição Esportiva, 14(1), 1-7.
- Wu, g. (2009). Amininoácidos: metabolismo, funções e nutrição. Amininoácidos, 37(1), 1-17.
- « História da ecologia industrial, objetivos, exemplos
- Características da fenilalanina, funções, biossíntese, alimentos »

