Características da fenilalanina, funções, biossíntese, alimentos
- 3147
- 201
- Ernesto Bruen
O Fenilalanina (Phe, f) é um dos 9 aminoácidos essenciais, ou seja, não é sintetizado endogenamente pelo corpo humano. Em sua cadeia lateral, este aminoácido tem um composto aromático não polar que o caracteriza.
A fenilalanina, ou ácido β-fenil-α-amino-amino, foi identificado pela primeira vez em 1879 por cientistas j. H. Schulze e m. Barbieri de uma planta da família Fabaceae conhecida como Lupinus luteus ou "Altramuz amarelo".
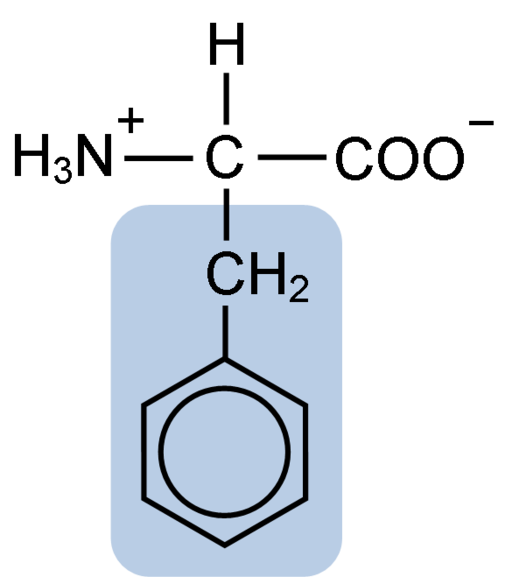
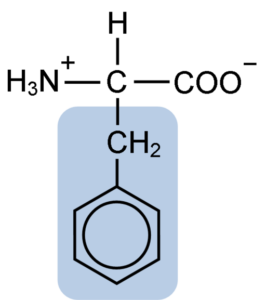 Estrutura química da fenilalanina de aminoácidos (fonte: clavecina [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons)
Estrutura química da fenilalanina de aminoácidos (fonte: clavecina [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons) O DiPéptide l-fenilalanina-l-aspartil é conhecido como aspartame ou "nutrasweet", que é um adoçante produzido sinteticamente e amplamente usado em restaurantes e cafés, normalmente para adoçar bebidas como café, chá, limonada e outras bebidas.
Em frutas com características acaloradas, a conversão de L-fenilalanina em ésteres fenólicos como eugenol e seus derivados metílicos é o que dá origem ao cheiro floral doce ou semelhante ao mel típico de bananas e fruas de bananas quando maduro.
Dependendo do formulário, a fenilalanina pode ter sabores diferentes. Por exemplo, a forma L-fenilalanina tem um aroma e sabor doces, enquanto a d-fenilalanina é um pouco amarga e geralmente tood.
Como tem um forte caráter hidrofóbico, a fenilalanina é um dos principais constituintes de muitas das resinas na natureza, como o poliestireno. Essas resinas, ao entrar em contato com moléculas de água, formam uma estrutura de proteção ou cobertura conhecida como "Clatrato".
Os genes que codificam a via de biossíntese da fenilalanina são usados pelos botânicos como relógios evolutivos, pois foi descoberto que estes estão relacionados à diversificação morfológica de plantas terrestres.
[TOC]
Características e estrutura
A fenilalanina compartilha com todos os aminoácidos que o grupo carboxil (-coh), o grupo amino (-NH2) e o átomo de hidrogênio (-h) que são ligados a um átomo central de carbono conhecido como α de carbono α. Além disso, é claro, possui uma cadeia lateral ou grupo r característico.
A fenilalanina é um dos três aminoácidos que têm anéis aromáticos ou benzeno como substituintes em cadeias laterais. Esses compostos não são polares e, portanto, são altamente hidrofóbicos.
O aminoácido em questão é especialmente hidrofóbico, porque, diferentemente da tirosina e do triptofano (os outros dois aminoácidos com anéis aromáticos) não possui grupos amino ou hidroxila unidos em seu anel benzeno.
O grupo aromático, benzóico ou sandilalanina de fenilalanina tem a estrutura típica de benzeno: o anel cíclico é estruturado por 6 átomos de carbono que têm ressonância entre eles devido à presença de três ligações duplas e três ligações simples dentro.
Ao contrário da tirosina e do triptofano, que podem adquirir carga positiva e negativa, respectivamente, a fenilalanina mantém sua carga neutra, uma vez que o anel benzeno não é ionizado e as cargas de grupos carboxil e amino se neutralizam.
Classificação
Os aminoácidos são classificados em diferentes grupos, de acordo com as características que suas cadeias laterais ou grupos R, já que podem variar em tamanho, estrutura, grupos funcionais e até em carga elétrica.
Como mencionado, a fenilalanina é classificada dentro do grupo de aminoácidos aromáticos, junto com tirosina e triptofano. Todos esses compostos têm anéis aromáticos em sua estrutura, no entanto, a tirosina e o triptofano têm grupos ionizáveis nos substituintes de seus grupos R.
Pode atendê -lo: especiação alopátrica: conceito, processo e exemplosAs características de absorção da luz da proteína em um comprimento de onda de 280 nm são devidas à presença dos aminoácidos classificados dentro do grupo fenilalanina, pois eles absorvem facilmente a luz ultravioleta através de seus anéis aromáticos.
No entanto, foi demonstrado que a fenilalanina absorve em muito menos proporções que a tirosina e o triptofano; portanto, na análise de algumas proteínas, sua absorvância é previsível.
Estereoquímica
Todos os aminoácidos têm um carbono quiral central, que possui quatro átomos ou grupos unidos e, como já disse, esse átomo é identificado como carbono α. Com base nesse carbono, pelo menos dois estereoisômeros de cada aminoácido podem ser encontrados.
Estereoisômeros são moléculas com imagens especulares, que têm a mesma fórmula molecular, mas que não se sobrepõem como, por exemplo, mãos e pés. Os compostos que giram experimentalmente o plano de luz polarizado direito são indicados com a letra D, e aqueles que o fazem à esquerda, com a letra L.
É importante comentar que a distinção entre as formas de d-fenilalanina e L-fenilalanina é essencial para entender o metabolismo deste aminoácido no corpo dos vertebrados.
A forma de L-fenilalanina é metabolizada e explorada para a construção de proteínas celulares, enquanto a d-fenilalanina foi encontrada na corrente sanguínea como um agente protetor contra espécies reativas de oxigênio (ROS).
Funções
Nos anos 90, pensava -se que a fenilalanina estava apenas em algumas espécies de plantas. No entanto, hoje se sabe que está presente em quase todos os domínios hidrofóbicos de proteínas, de fato, a fenilalanina é o principal componente das espécies químicas aromáticas de proteínas.
Nas plantas, a fenilalanina é um componente essencial de todas as proteínas; Além disso, é um dos precursores de metabólitos secundários, como fenilpropanóides (que fazem parte dos pigmentos) de moléculas defensivas, flavonóides, biopolímeros como lignina e suberina, entre outros.
A fenilalanina é a estrutura básica para formar muitas das moléculas que mantêm a homeostase neuronal, entre as quais são peptídeos como vasopressina, melanotropina e encefalina. Além disso, este aminoácido está diretamente envolvido na síntese do hormônio adrenocortópico (ACTH).
Como grande parte dos aminoácidos de proteínas, a fenilalanina faz parte do grupo de aminoácidos cetogênicos e glicogênicos, pois fornece o esqueleto de carbono dos intermediários do ciclo de Krebs, necessário para o metabolismo de energia celular e corporal.
Quando em excesso, a fenilalanina é transformada em tirosina e posteriormente em fumarato, um intermediário do ciclo Krebs.
Biossíntese
A fenilalanina é um dos poucos aminoácidos que não podem ser sintetizados pela maioria dos organismos de vertebrados. Atualmente, apenas rotas biossintéticas são conhecidas por este aminoácido em organismos procarióticos, em leveduras, em plantas e em algumas espécies de fungos.
Os genes responsáveis pela rota de síntese são muito preservados entre plantas e microorganismos; portanto, a biossíntese tem etapas semelhantes em quase todas as espécies. Mesmo algumas enzimas na rota estão presentes em alguns animais, no entanto, estes não são capazes de sintetizá -la.
Biossíntese de fenilalanina em plantas
Nas espécies vegetais, a fenilalanina é sintetizada através de uma rota metabólica interna nos cloroplastos conhecidos como "Rota de Predetenato". Esta rota está metabolicamente relacionada à "rota Shikimato", através do L-AROGENATO, um dos metabólitos produzidos durante este último.
Pode atendê -lo: topoisomerase: o que são, características, funções, tiposA enzima inyddratasa é a enzima de madeira catalisa uma reação de três etapas, na qual transforma o anel aromático do arogenato no anel benzênico característico da fenilalanina.
Esta enzima catalisa uma transaminação, desidratação e decaimento.
O predeneato ao lado do fenilpiruvato acumulado no interior (a luz) do cloroplasto, pode ser convertido em fenilalanina por reação catalisada pela enzima aminotransferase propenato, que transfere um grupo amino para fenilpiruvato e que é reconhecido por incumido por the -arogenato para a síntese de fenilalanina.
Em algumas espécies de Pseudomonas Rotas alternativas foram descritas para a do Profenato, que usam enzimas diferentes, mas cujos substratos para a síntese de fenilalanina também são o predetenato e o arogenato.
Degradação
A fenilalanina pode ser metabolizada de várias maneiras a partir da comida. No entanto, a maior quantidade de estudos se concentra em seu destino nas células do tecido nervoso central e tecidos renais.
O fígado é o órgão principal para degradação ou catabolismo da fenilalanina. Nos hepatócitos, há uma enzima conhecida como hidroxilase fenilalanina, capaz de transformar a fenilalanina em tirosina ou no composto L-3,4-di-hidroxifenilalanina (l-dopa).
O composto L-DOPA é um precursor da noradrenalina, epinefrina e outros hormônios e peptídeos com atividade no sistema nervoso.
A fenilalanina pode ser oxidada nas células cerebrais por meio da enzima tirosina da hidroxilase, responsável por catalisar a conversão da fenilalanina em dopacrome na presença de ácido l-ascórbico.
Anteriormente, pensava -se que a hidroxilase tirosina hidroxilase apenas tirosina, no entanto, verificou -se que esse hidroxílio de fenilalanina e tirosina na mesma proporção e que a hidroxilação da fenilalanina inibe a hidroxilação da tirosina.
Atualmente, sabe -se que altas proporções de tirosina inibem a atividade enzimática da hidroxilase tirosina, mas o mesmo não é verdadeiro para a fenilalanina.
Alimentos ricos em fenilalanina
Todos os alimentos ricos em proteínas têm um teor de fenilalanina entre 400 e 700 mg para a porção de alimentos ingeridos. Alimentos como óleo de bacalhau, atum fresco, lagostas, ostras e outros bivalves, contêm mais de 1.000 mg por porção de alimentos ingeridos.
Carne bovina e porco também têm altos níveis de fenilalanina. No entanto, eles não são tão altos quanto as concentrações presentes em animais marinhos. Por exemplo, bacon, carne bovina, fígado, frango e laticínios têm entre 700 e 900 mg de fenilalanina por ração de alimentos.
Nozes como amendoim e nozes de diferentes tipos são outros alimentos que têm uma boa quantidade de fenilalanina. Grãos como soja, grão de bico e outras leguminosas podem fornecer entre 500 e 700 mg de fenilalanina por parte.
Como fonte alternativa, a fenilalanina pode ser metabolizada do aspartame.
Benefícios da sua ingestão
A fenilalanina é encontrada em todos os alimentos ricos em proteínas que consumimos. O consumo diário mínimo para adultos e o tamanho médio são de cerca de 1000 mg, necessários para a síntese de proteínas, hormônios como dopamina, de diferentes neurotransmissores, etc.
Pode servir você: qual é a diversidade natural da terra?O consumo desse excesso de aminoácido é prescrito para pessoas que têm distúrbios depressivos, dor nas articulações e doenças da pele, uma vez que seu consumo aumenta a síntese de proteínas e biomoléculas transmitindo como epinefrina, norepinafrina e dopamina.
Alguns estudos sugerem que a fenilalanina consumida em excesso não produz melhorias significativas em nenhum desses distúrbios, mas sua conversão em tirosina, que também é usada para a síntese de moléculas de sinalização, pode explicar os efeitos positivos na sinalização celular no sistema nervoso na sistema nervoso.
Drogas formuladas contra constipação têm núcleos estruturados por fenilalanina, tirosina e triptofano. Geralmente, esses medicamentos contêm misturas desses três aminoácidos em suas formas L- y d-.
Distúrbios de deficiência
Os níveis de fenilalanina sanguínea são importantes para manter o funcionamento adequado do cérebro, uma vez que a fenilalanina, a tirosina e o triptofano são os substratos para a montagem de diferentes neurotransmissores.
Alguns distúrbios se relacionam, antes, com déficits no metabolismo deste aminoácido, que gera um excesso dele, em vez de uma deficiência.
A fenilcetonúria, uma doença hereditária incomum em mulheres, afeta a hidroxilação hepática da fenilalanina e torna os níveis plasmáticos desse aminoácido excessivo, de modo que uma apoptose neuronal é induzida e afeta o desenvolvimento normal do cérebro.
Se uma mulher com fenilcetonúria engravida, o feto pode apresentar o que é conhecido como "hiperfenilalaninemia materna" síndrome fetal ".
Isso ocorre porque o feto tem altas concentrações de fenilalanina no sangue (quase o dobro dos padrões), cuja origem está relacionada à ausência de fenilalanina hidroxilase hepática do feto, que não se desenvolve até as 26 semanas de gestação.
A síndrome fetal por hiperfenilalaninemia materna, produz microcefalia fetal, abortos recorrentes, doenças cardíacas e até malformações renais.
Referências
- Biondi, r., Brancorsini, s., Poli, g., Egidi, m. G., Capodicasa, e., Bottiglieri, l.,… & Micu, r. (2018). Detecção e eliminação de radicais hidroxila via hidroxilação de d-fenilalanina em fluidos humanos. Talanta, 181, 172-181
- Cho, m. H., Coréia, o. R., Yang, h., Bedgar, d. eu., Laskar, d. D., Anterola, a. M.,… & Kang, c. (2007). Biossíntese de fenilalanina em Arabidopsis da Tália Identificação e caracterização do argenato Deiddratas. Journal of Biological Chemistry, 282 (42), 30827-30835.
- Fernstrom, J. D., & Fernstrom, M. H. (2007). Tirosina, fenilalanina e síntese e função de catococolamina no cérebro. The Journal of Nutrition, 137 (6), 1539S-1547S.
- Hou, j., Vázquez-González, m., Fadeev, m., Liu, x., Lavi, r., & Willner, eu. (2018). Oxidação catalisada e eletrocatalisada de L-tisina e L-fenilalanina em dopachrome por nanozimas. Nano Letters, 18 (6), 4015-4022.
- Nelson, d. eu., Lehninger, a. eu., & Cox, M. M. (2008). Lehninger Principles of Biochemistry. Macmillan.
- Perkins, r., & Vaida, V. (2017). A fenilalanina aumenta a permeabilidade da membrana. Jornal da American Chemical Society, 139 (41), 14388-14391.
- Plimmer, r. H. PARA. (1912). A constituição química das proteínas (vol. 1). Longmans, verde.
- Tensley, g. (2018). Healthline. Recuperado em 5 de setembro de 2018, de www.Healthline.com/nutrição/fenilalanina
- Tohge, t., Watanabe, m., Hoefgen, r., & Fernie, para. R. (2013). Biossíntese de shikimate e fenilalanina na linhagem verde. Frontiers in Plant Science, 4, 62.
- « Características de isoleucina, funções, biossíntese, comida
- Características da frente nacionais, objetivos, presidentes »

