Holmio

- 4799
- 916
- Ernesto Bruen
 Amostra de ultrapura metálica de holm. Fonte: imagens de alta resolução de elementos químicos [CC por 3.0 (https: // CreativeCommons.Org/licenças/por/3.0)]
Amostra de ultrapura metálica de holm. Fonte: imagens de alta resolução de elementos químicos [CC por 3.0 (https: // CreativeCommons.Org/licenças/por/3.0)] O que é o Holmio?
Ele Holmio É um elemento metálico pertencente ao bloco F da tabela periódica, especificamente para o período dos Lantanides. É, portanto, um membro das terras raras, ao lado de Erbio, Itrio, Disposio e Iterbio. Todos esses compõem uma série de minerais (Xenotima ou Gadolinita) que são difíceis de separar através de métodos químicos convencionais.
Seu símbolo químico é o HO, com um número atômico de 67, e sendo menos abundante do que seus vizinhos disposio (66Dy) e Erbio (68Er). É dito então que Oddo-Harkins regra obedece-se. Holmius é um daqueles metais raros que quase ninguém conhece ou suspeita de sua existência; Mesmo entre produtos químicos, geralmente não é mencionado com muita frequência.
Nas áreas da medicina, Holmio é conhecido pelo uso de seu laser em cirurgias para combater as patologias da próstata. Ele também representa o material promissor para a fabricação de eletromagnets e computadores quânticos, devido às suas propriedades magnéticas incomuns.
Compostos de holmio, trivalentes, ho3+, Eles apresentam a peculiaridade de exibir uma cor dependente da luz com a qual são irradiadas. Se for fluorescente, a cor desses compostos muda de amarelo para rosa. Da mesma forma, acontece com suas soluções.
História
A descoberta do Holmio é atribuída a dois produtos químicos suíços, Marc DeFontaine e Jacques-Louis Soret, que em 1878 foram detectados espectroscopicamente enquanto analisava os minerais de Genebra de Terras Raras. Eles o chamaram de elemento x.
Apenas um ano depois, em 1879, o químico sueco por teodor cleve administrou2QUALQUER3). Esse óxido, contaminado por outras impurezas, mostrou uma coloração marrom, que ele chamou de 'Holmia', que significa derrame em latim.
Pode servir a você: Reação Exerrogônica: Características e ExemplosAlém disso, Cleve obteve outro material verde: 'Thulia', que se torna tulio óxido. O problema dessa descoberta é que nenhum dos três produtos químicos pode obter uma amostra suficiente pura do óxido de Holm, pois foi contaminado por átomos de Docch, outro metal lantanida.
Não era nada além de em 1886 que o produto químico francês, Paul LeCoq, de Boisbaudran, isolou o óxido de holm por precipitação fracionada. Esse óxido subsequentemente passou por reações químicas para produzir sais de Holmio, que foram reduzidos em 1911 pelo químico sueco Otto Holmberg; E assim, as primeiras amostras metálicas de Holm apareceram.
No entanto, atualmente os íons de Holmio, Hol3+, Eles são extraídos por cromatografia de troca iônica, em vez de recorrer a reações convencionais.
Propriedades de Holm
 Localização de Holmio na tabela periódica. Fonte: Vectorização: Sushant Savla 05:51, 9 de junho de 2019 (UTC), CC BY-SA 4.0, via Wikimedia Commons
Localização de Holmio na tabela periódica. Fonte: Vectorização: Sushant Savla 05:51, 9 de junho de 2019 (UTC), CC BY-SA 4.0, via Wikimedia Commons Aparência física
Metal prateado, macio, dúctil e maleável.
Número atômico
67 (67Ho)
Massa molar
164,93 g/mol
Ponto de fusão
1461 ºC
Ponto de ebulição
2600 ºC
Densidade
À temperatura ambiente: 8,79 g/cm3
Apenas quando derrete ou derrete: 8,34 g/cm3
Calor de fusão
17 kJ/mol
Calor de vaporização
251 kJ/mol
Capacidade de calor molar
27.15 J/(mol · k)
Eletro-negatividade
1.23 na escala Pauling
Energias de ionização
Primeiro: 581,0 kJ/mol (HO+ gasoso)
Segundo: 1140 kJ/mol (HO2+ gasoso)
Terceiro: 2204 KJ/mol (HO3+ gasoso)
Condutividade térmica
16,2 W/(M · K)
Resistividade elétrica
814 Nω · M
Números de oxidação
O Holm pode ser apresentado em seus compostos com os seguintes números ou estados de oxidação: 0, +1 (HO+), +2 (HO2+) e +3 (HO3+). De todos eles, +3 é de longe o mais comum e estável. Portanto, o Holm é um metal trivalente, formando compostos (iônicos ou parcialmente iônicos), onde participa como um íon ho3+.
Pode atendê -lo: acetato de etilaPor exemplo, nos seguintes compostos, o Holm é encontrado com +3 Número de oxidação: HO2QUALQUER3 (Ho23+QUALQUER32-), Ho (oh)3, Hoi3 (Ho3+Yo3-) e ho2(SW4)3.
O ho3+ E suas transições eletrônicas são responsáveis pelos compostos deste metal, pareça amarelo marrom. No entanto, quando eles irradiam com luz fluorescente, ficam rosa. O mesmo vale para suas soluções.
Isótopos
Holmio é apresentado na natureza como um único isótopo estável: 165Ho (100% de abundância). No entanto, existem radioisótopos artificiais com consideráveis tempos de meia -vida. Entre eles, temos:
-163Ho (t1/2 = 4570 anos)
-164Ho (t1/2 = 29 minutos)
-166Ho (t1/2 = 26.763 horas)
-167Ho (t1/2 = 3,1 horas)
Ordem magnética e momento
O Holm é um metal paramagnético, mas pode se tornar ferromagnético a uma temperatura de 19 K, exibindo propriedades magnéticas muito fortes. É caracterizado por ter o momento magnético (10,6 μB) maiores entre todos os elementos químicos, bem como uma permeabilidade magnética incomum.
Reatividade
O Holm é um metal que em condições normais não é muito rápido, por isso é preciso para perder seu brilho. No entanto, quando ele é aquecido com um isqueiro, torna -se amarelado, o produto da formação de uma camada de óxido:
4 HO + 3 O2 → 2 HO2QUALQUER3
Reage com ácidos diluídos ou concentrados para causar seus respectivos sais (nitratos, sulfatos, etc.). No entanto, e surpreendentemente, ele não reage com o ácido fluorérico, já que uma camada HOF3 protege de sua degradação.
O Holmio também reage com todos os halogênios para produzir seus respectivos halogenuros (Hof3, Hocl3, Hobr3 e hoi3).
Estrutura química
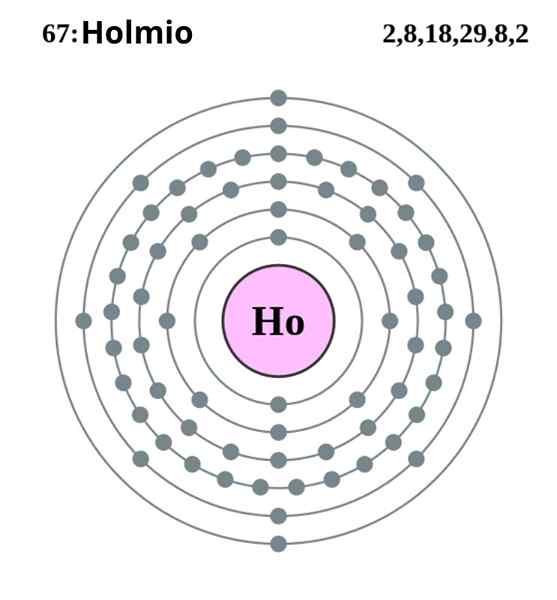 Configuração eletrônica de Holmio. Fonte: Pumba (Trabalho original de Greg Robson) Creative Commons Reconhecimento Share sob a mesma licença 2.0 Inglaterra e país do País de Gales
Configuração eletrônica de Holmio. Fonte: Pumba (Trabalho original de Greg Robson) Creative Commons Reconhecimento Share sob a mesma licença 2.0 Inglaterra e país do País de Gales O Holmio cristaliza em uma estrutura hexagonal compacta, HCP (para seu acrônimo em inglês: hexagonal fechado). Em teoria, os átomos de HO permanecem coesos graças à ligação metal formada pelos elétrons de seus orbitais 4F, de acordo com sua configuração eletrônica:
Pode servir a você: diluição: conceito, como é feito, exemplos, exercícios[Xe] 4fonze 6s2
Tais interações, bem como o sistema de energia de seus elétrons, definem as propriedades físicas do Holmio. Este metal não se sabe nenhum outro alotopo ou polimorfo, nem mesmo sob altas pressões.
Formulários
Reações nucleares
O Holmio Atom é um bom absorvente de nêutrons, por isso ajuda a controlar o desenvolvimento de reações nucleares.
Espectroscopia
As soluções de óxido de holmio são usadas para calibrar os espectrofotômetros, porque seu espectro de absorção quase sempre permanece, independentemente das impurezas que ele contém. Ele também mostra bandas agudas muito características associadas ao Holmio Atom, e não a seus compostos.
Corante
Os átomos de Holmio são capazes de fornecer coloris avermelhados para vidro e gemas artificiais de circitésita cúbica.
Ímãs
A temperaturas extremamente baixas (30 K ou menos), o Holmius exibe propriedades magnéticas interessantes, que são usadas para fabricar eletromas poderosos, onde ajuda a concentrar o campo magnético resultante.
Tais materiais magnéticos são destinados à ressonância magnética nuclear; para o desenvolvimento de discos rígidos, com memórias que oscilam na ordem dos petabytes ou terabytes; e possivelmente fabricar computadores quânticos.
Holmio Laser
Um cristal de granada ititrio-alumínio (YAG) pode ser doping com átomos de holmio para emitir uma radiação cujo comprimento de onda é de 2 μm; Isto é, temos um laser holm. Graças a ele, o tecido tumoral pode ser cortado com precisão sem causar sangramento, uma vez que a energia fornecia os calçados imediatamente.
Este laser tem sido usado recorrente em cirurgias de próstata e odontologia, bem como para eliminar células cancerígenas e pedras nos rins.

