Hipoclorito de sódio (naclo)
- 2688
- 157
- Lonnie MacGyver
Explicamos o que é hipoclorito de sódio, suas propriedades, síntese e aplicações
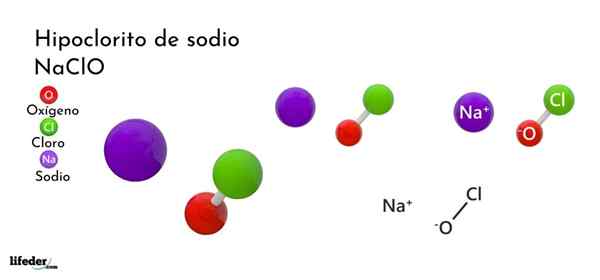
 Fórmula e estrutura de hipoclorito de sódio
Fórmula e estrutura de hipoclorito de sódio O que é hipoclorito de sódio?
Ele hipoclorito de sódio (Naclo) é um sal ternário e inorgânico de sódio. Comercialmente é alcançado como soluções aquosas e é o agente ativo desses produtos domésticos e industriais. Essas soluções são conhecidas com os nomes de cloro branco, refrigerante, mais branco, líquido ou mais refinado, bebidas alcoólicas de dardo.
Na água, o hipoclorito de sódio exibe as mesmas propriedades oxidantes do cloro gasoso; portanto, uma solução desse sal é equivalente a transportar o referido composto dentro de uma garrafa de plástico. De fato, o cloro disponível nesses recipientes é um indicador de concentração e poder de branqueamento da solução de hipoclorito de sódio.
Este sal ternário na água pode muito bem ser considerado uma solução simples de cloro aquosa; No entanto, também existem outras formas disponíveis, como sólido no caso de hipoclorito de cálcio e cloro líquido. Os três têm o mesmo poder oxidante e seus usos dependem de variáveis como conforto, desempenho ou tempo.
Fórmula
A fórmula química de hipoclorito de sódio é Naclo. É composto de um cátion+ E um ânion clo-. Íons Na+ Eles sentem atração eletrostática pelos íons clo-, Este último adotando uma estrutura tetraédrica com uma hibridação SP3.
A fórmula indica a proporção de íons no estado de anidrido, que é igual a 1: 1. No entanto, isso se aplica apenas a anidrido.
No caso de hipoclorito de sódio hidratado -um das formas mais estáveis para esta fórmula química de sal é Naclo · 5h2QUALQUER.
Onde está o hipoclorito de sódio?
O NACLO é um produto sintético e, devido à sua reatividade, é encontrada apenas em regiões locais onde é usado, especialmente em águas residuais, solos ou mesmo em emanações de água potável.
No corpo humano abundam os íons cloreto, que poderiam participar de reações redox que produzem hipoclorito de sódio dentro do organismo.
Pode atendê -lo: óxidos de metalSíntese
Ao longo da história, Naclo foi preparado para vários métodos. O mais simples consiste em uma solução de cloro na água, ou soluções de NA2Co3 Esse lançamento co2 Por ação do ácido hipocloroso (HCLO).
Outros métodos usam a salmoura do mar como matéria -prima através de um processo eletrolítico. Sob agitação mecânica eficiente, o CL2 e o NaOH gerado por NaCl e água reage e se torna naclo:
Cl2(g) + 2naoh (aq) => naclo + nacl + h2O + Q (calor)
Hoje, o processo da prostituta fabrica esse composto em grandes escalas, que consiste em uma versão aprimorada do método anterior descrito.
Usos/aplicações de clorito de sódio
 Uma das principais aplicações de hipoclorito de sódio é para as roupas de alvejante
Uma das principais aplicações de hipoclorito de sódio é para as roupas de alvejante As aplicações de hipoclorito de sódio mais comuns são:
- O hipoclorito de sódio é usado como agente clareador em têxteis, nos detergentes que o incorporam e na indústria de papel.
- Seu uso como agente bactericida e desinfetante é muito amplo, usando purificação de água e tratamento de águas residuais.
- Sua utilidade em desinfetar o equipamento usado na preparação de alimentos e o processamento de frutas e vegetais é conhecido. Também é usado com a mesma função desinfetante na produção de cogumelos, gado, porcos e aves.
- O hipoclorito de sódio é usado na indústria de petróleo no estágio de refino.
- Na casa, a capacidade de branqueamento do hipoclorito de sódio é usada na lavagem de roupas brancas, e ação desinfetante na limpeza de banhos, pisos, etc.
- O hipoclorito de sódio é usado na terapia endodôntica, especificamente no tratamento da raiz do dente. Este tratamento usa a solução Dakin (clone a 0,5 %) que preserva o tecido dental vital ao dissolver o tecido necrótico.
Propriedades do hipoclorito de sódio
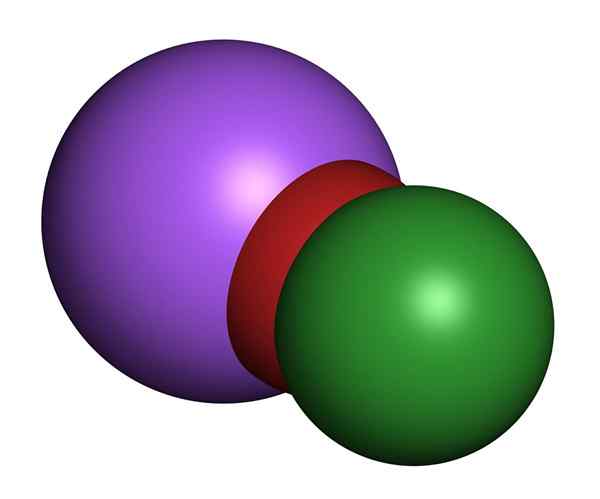 Modelo de hipoclorito de sódio 3D. Cloro (verde), oxigênio (vermelho), sódio (roxo)
Modelo de hipoclorito de sódio 3D. Cloro (verde), oxigênio (vermelho), sódio (roxo) As soluções de hipoclorito de sódio à temperatura ambiente são incolores e têm um cheiro de cloro doce. As propriedades físicas variam dependendo das concentrações de sal dissolvidas na água. Todos têm colorias amarelas.
Através de técnicas de cristalização, essas soluções obtêm o naclo sólido · 5h2Ou, cujos cristais são planos verdes.
Este sal hidratado tem um peso molecular aproximado de 164 g/mol, uma densidade de 1,11 g/ml, é muito solúvel em água e se decompõe para 101 ºC. O naclo · 5h2Ou também é sensível às mesmas reações de anidrido.
Por que o sal é penta -hidrato? Enquanto o naclo cristaliza em seu ambiente aquoso, as moléculas de água envolvem os íons em uma esfera aquosa.
Pode -se pensar que três dessas moléculas interagem com os pares de elétrons não compartilhados da forma de CL: uma ponte de hidrogênio com o O e o último é atraído pelo NA.
No entanto, são os estudos focados na estrutura cristalina desse sólido que tem a verdadeira resposta para esta pergunta.
Equilíbrio aquoso
O ânion clo- Participe do equilíbrio de hidrólise seguinte:
HCLO (AC) + H2Ou (l) clo-(AC) + H+(AC)
Se a acidez da solução aumentar, o equilíbrio se move para a esquerda, produzindo HCLO.
Esse ácido é ainda mais instável que o hipoclorito e, portanto, a decomposição diminui a concentração do agente ativo. Se o pH for básico (maior que 11), garante a existência do clo- e tempo de vida do produto.
No entanto, a alcalinidade excessiva desencadeia outros problemas em suas aplicações. Por exemplo, uma solução de Naillo muito básica danifica as roupas em vez de apenas branquear.
Além disso, em meio aquoso, o HCLO também é transformado em cloro, o que explica as cores amarelas dessas soluções:
Pode atendê -lo: concentração percentualHCLO (AC) CL2(g) + h2Ou (l)
Desproporção
O átomo de cloro no hipoclorito de sódio tem um estado de oxidação de +1, precisando de apenas dois elétrons para completar seu octeto de Valencia.
Por outro lado, sua configuração eletrônica é [ne] 3s23p5, Ser capaz de esvaziar todos os elétrons de seus orbitais "P", mais energia.
Isso resulta no hipoclorito sofre de reações de desproporção em íons com estados de oxidação de +1 e +5:
3cl-(AC) 2Cl-(AC) + CLO3-(AC)
Essa reação em solução aquosa é acelerada com os aumentos de temperatura e concentrações de hipoclorito. Da mesma forma, a reação continua por um mecanismo diferente catalisado pelos óxidos de luz e metal de cobre, níquel e cobalto:
2naocl (aq) => o2(g) + 2NAcl (aq)
O namento anidrido é desproporcional a uma velocidade muito mais rápida, até explodindo.
Agente oxidante
O átomo de cloro pode aceitar elétrons de espécies negativas (nucleofílico). Anidrido é um poderoso agente oxidante, reduzindo nos ânions de cloreto (CL-).
No caso de Naclo · 5h2Ou, pensa -se que as moléculas de água impedem parcialmente o clo- Eles sofrem ataques nucleofílicos.
No entanto, dada a linearidade estrutural do clo-, Essas moléculas de água não diminuem "ataques" o suficiente no átomo de Cl. É por esse motivo que o hipoclorito de sódio é um forte agente oxidante.
Referências
- Wikipedia. (2018). Hipoclorito de sódio. Recuperado em 7 de abril de 2018, de: em.Wikipedia.org
- Francisco J. ARNAIZ. (2016). Experimentos para o Laboratório de Química Inorgânica Verde. Departamento de Química, Universidade de Burgos, Espanha.
- Livro químico. (2017). Hipoclorito de sódio. Recuperado em 7 de abril de 2018, de: ChemicalBook.com
- Brian Clegg. (9 de março de 2016). Hipoclorito de sódio. Recuperado em 7 de abril de 2018, de: química.com
- Oxychem. (Dezembro de 2014). Manual de hipoclorito de sódio. Recuperado em 7 de abril de 2018, de: Oxy.com
- PubChem. (2018). Hipoclorito de sódio. Recuperado em 7 de abril de 2018, de: PubChem.NCBI.Nlm.NIH.Gov.

