Estrutura de hidróxido de níquel (iii), propriedades, usos, riscos
- 3119
- 937
- Terrell Stokes
Ele Hidróxido de níquel (iii) É um composto inorgânico em que o metal de níquel tem um número de oxidação de 3+. Sua fórmula química é Ni (OH)3. De acordo com as fontes consultadas, até agora não foi possível verificar a existência de hidróxido de níquel (iii) ou (OH)3, Mas níquel oxo-hidroxido (iii), criança (OH) foi obtido.
O níquel (iii) nio (OH) oxo -hidroxido é um sólido cristalino preto que se cristaliza de duas maneiras: a forma beta e a gama. A forma cristalina mais comum (OH) é beta.
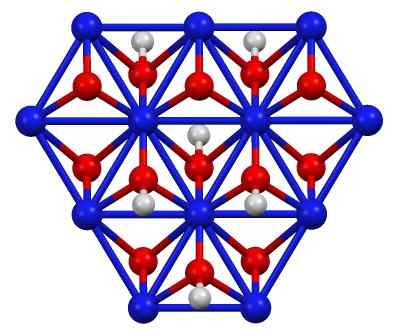
 Estrutura de oxo -hidroxido de níquel (III), criança (OH). Azul = níquel, vermelho = oxigênio, branco = hidrogênio. Autor: Smokefoot. Fonte: Trabalho próprio. Fonte: Wikipedia Commons
Estrutura de oxo -hidroxido de níquel (III), criança (OH). Azul = níquel, vermelho = oxigênio, branco = hidrogênio. Autor: Smokefoot. Fonte: Trabalho próprio. Fonte: Wikipedia Commons A criança (OH) pode ser obtida pela oxidação de soluções de nitrato de níquel (ii) (ou (não3)2) com cloro (CL2) ou bromo (BR2) Na presença de hidróxido de potássio (KOH). O níquel (iii) oxo -hidróxido é muito solúvel em ácidos. Possui aplicação em baterias de níquel, em Superca.
Níquel (iii) nio (oh) e hidróxido de níquel (ii) ou (oh) (oh)2 Eles estão unidos na operação da maioria de suas aplicações, pois ambos fazem parte da mesma equação de redução de óxido.
Sendo um composto de níquel, a criança (OH) apresenta os mesmos riscos de outros sais de níquel, ou seja, irritação da pele ou dermatite e câncer.
[TOC]
Estrutura cristalina
O oxo -hidroxido de níquel (III) cristaliza de duas maneiras: beta e gama. A forma beta β-nio (OH) tem uma estrutura muito semelhante a β-ni (OH)2, o que parece lógico porque o primeiro vem da oxidação deste último.
A forma gama γ-nio (OH) é o produto de oxidação do hidróxido de níquel (II) em sua forma alfa, α-ni (OH)2. Como o último, Gamma tem uma estrutura de camada com íons metálicos alcalinos, ânions e água intercalados entre as camadas.
Configuração eletronica
Na criança (OH), o níquel é encontrado no estado de oxidação 3+, o que significa que 3 elétrons estão ausentes em suas camadas mais externas, ou seja, dois elétrons da camada 4 estão ausentess e um elétron da camada 3d. A configuração eletrônica de Ni3+ Na criança (oh) é: [ar] 3d7, Onde [AR] é a configuração eletrônica do Noble Argon Gas.
Pode servir você: link piNomenclatura
- Nio (OH): níquel oxo -hidroxido (III)
- Níquel preto
Propriedades
Estado físico
Sólido cristalino preto.
Solubilidade
Nio (OH) oxo -hidróxido é muito solúvel em ácidos. A fase gama se dissolve em ácido sulfúrico com evolução de oxigênio.
Outras propriedades
Na água quente, torna -se um oxo -hidróxido de níquel (ii) e (iii), ou3QUALQUER2(OH)4.
Ele se decompõe para 140 ºC em níquel (II) (oxidado infantil e oxigênio.
A fase gama (γ-nio (OH)) pode ser obtida de várias maneiras, por exemplo, tratando níquel com uma mistura derretida de peróxido de sódio (Na2QUALQUER2) e hidróxido de sódio (NaOH) a 600 ºC e resfriamento em água gelada.
A fase gama quebra quando aquecida para 138 ºC.
Formulários
Em baterias de níquel
A bateria de níquel-hidrum de Edison, na qual o KOH é usado como eletrólito, é baseado na reação de níquel oxo-hidroxido (III) com ferro:
Download:
Fe + 2nio (OH) + H2Ou fé (oh)2 + 2ni (oh)2
Fardo:
É uma reação reversível de redução de óxido.
No ânodo dessas baterias, ocorre uma série de processos químicos e eletroquímicos. Abaixo está um esquema geral:
Download
β-ni (OH)2 ⇔ β-nio (OH) + h+ + e-
Fardo
Envelhecimento ↑ ↓ sobrecarga
Download
α-ni (OH)2 ⇔ γ-nio (OH) + h+ + e-
Fardo
Pode atendê -lo: arsênico: história, estrutura, propriedades, usosNa tecnologia de bateria de níquel, o níquel oxo -hidroxido (III) Nio (OH) é chamado de "Massa ativa de níquel".
 Baterias recarregáveis de níquel. Autor: Superusergeneric. Fonte: Trabalho próprio. Fonte: Wikipedia Commons.
Baterias recarregáveis de níquel. Autor: Superusergeneric. Fonte: Trabalho próprio. Fonte: Wikipedia Commons. Na eletrocatálise como um catalisador regenerável
A criança (OH) tem sido usada com sucesso na eletrotossíntese de azpirazóis, através da oxidação eletrocatalítica de aminopirantezóis. Sua utilidade na síntese de ácidos carboxílicos a partir de álcoois ou compostos carbonil também foi comprovado.
 Obtendo um ácido carboxílico oxidando um álcool catalisado pela criança (OH). Fonte: Originalmente de In.Wikipedia. O uploader original do autor era v8rik em in.Wikipedia. Fonte: Wikipedia Commons
Obtendo um ácido carboxílico oxidando um álcool catalisado pela criança (OH). Fonte: Originalmente de In.Wikipedia. O uploader original do autor era v8rik em in.Wikipedia. Fonte: Wikipedia Commons Outro exemplo é o da conversão quantitativa de hidroximtetipiridina em um ácido piridocarboxílico. Nesse caso, o eletrodo de aço ou níquel correspondente ao ânodo é coberto com uma camada de criança (OH). O meio em que a eletrólise é realizada é alcalina.
Nessas reações, a criança (OH) atua como um mediador de redução outdoor, ou mediador "redox".
A eletrólise é realizada em uma célula com ânodo de níquel e cátodo de titânio, em meio alcalino. Durante o processo, ele é formado ou (oh)2 Na superfície do ânodo de níquel, que é rapidamente oxidado para a criança (OH):
Ni (oh)2 + Oh- - e- ⇔ nio (oh) + h2QUALQUER
A criança (OH) reage com o substrato orgânico e o produto orgânico desejado é obtido, regenerando o Ni (OH)2:
Nio (oh) + composto orgânico → ni (oh)2 + produtos
Quando o Ni (OH) se regenera2, A reação de catálise continua.
O uso da criança (OH) como eletrocatizador permite obter compostos orgânicos com baixos custos e de uma maneira ambientalmente amigável.
Em Super CardPisors
A criança (oh) junto com a ni (oh)2 Eles constituem excelentes materiais para eletrodos de supercaidência (inglês Supercapacitos).
Ni (oh)2 + Oh- ⇔ nio (oh) + h2Ou + e-
Eles têm alta capacitância, baixo custo e, de acordo com algumas referências, sob impacto ambiental.
 Condensadores em um circuito eletrônico. Autor: Pdphotos. Fonte: Pixabay.
Condensadores em um circuito eletrônico. Autor: Pdphotos. Fonte: Pixabay. No entanto, eles têm baixa condutividade. Isso é resolvido usando nanopartículas dos referidos compostos, pois aumenta a área da superfície e diminui a distância necessária para a difusão, o que garante alta velocidade de transferência de elétrons e/ou íons.
Pode atendê -lo: materiais elásticosNa oxidação de íons metálicos
Uma das aplicações comerciais do níquel oxo -hidróxido (III) baseia -se em sua capacidade de oxidar os íons cobalto (II) em solução para os íons cobalto (III).
Riscos
Em solução, o níquel é mais estável como um íon ou2+, Portanto, não é comum entrar em contato com Ni3+. No entanto, as precauções são as mesmas, porque o níquel, seja metálico, em solução ou na forma de seus sais sólidos, pode causar sensibilização da pele.
É aconselhável usar equipamentos e roupas de proteção, como escudo facial, luvas e sapatos de segurança. Tudo isso deve ser usado toda vez que existe a possibilidade de entrar em contato com as soluções de níquel.
Se ocorrer dermatite, deve ser tratado com um médico para descartar que é causado por níquel.
Quanto à possibilidade de inalação, é uma boa prática.
Todos os compostos de níquel são classificados pela Agência Internacional de Pesquisa do Câncer, ou IARC (acrônimo para inglês Agência Internacional de Pesquisa sobre Câncer), na categoria de agentes cancerígenos para o ser humano.
Isso é baseado em dados epidemiológicos e experimentais.
Referências
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- Lyalin, b.V. et al. Eletrorossíntese de Azopirazóis através da oxidação de n-alcilaminopirazóis em um ânodo da criança (OH) em método alcalinista aquoso para o homocóptero n-n. Letras de tetraedro. 59 (2018) 2741-2744. Recuperado de cientedirect.com.
- Liuyang, Zhang, et al. (2018). Materiais à base de níquel para supercapacitos. Materiais hoje. Recuperado de cientedirect.com
- Ettel, v.PARA. e Mosolu, M. PARA. (1977). Preparação de níquel preto. OU.S. Patente no. 4.006.216. 1 de fevereiro de 1977.
- SCHARBERT, b. (1993). Processo para oxidação de derivados de hidroximetilpiridina em derivados de ácido piridinecarboxílico em ânodos de hidróxido de óxido de níquel. OU.S. Patente no. 5.259.933. 9 de novembro de 1993.
- Kirk-Othmer (1994). Enciclopédia de tecnologia química. Volume 17. Quarta edição. John Wiley & Sons.
- Enciclopédia de química industrial de Ullmann. (1990). QUINTA EDIÇÃO. Volume em 17. Vch verlagsgellschaft mbh.
- McBreen, James. (1997). Hidróxidos de níquel. No manual de materiais de bateria. VCH Publisher. Recuperado de Osti.Gov.
- « Macrocomputers História, características, usos, exemplos
- Computadores analógicos em destaque, componentes, tipos »

