Estrutura de hidróxido de cromo, propriedades, síntese, usa
- 889
- 16
- Ernesto Bruen
Ele Hidróxido de cromo É um produto composto inorgânico da reação de uma base com um sal cromo. Sua fórmula química varia de acordo com o status de oxidação do cromo (+2 ou +3, para este tipo de composto). Assim tendo cr (oh)2 Para o hidróxido de cromo (II) e Cr (OH)3 Para hidróxido de cromo (iii).
Por razões eletrônicas, o CR2+ é mais instável que o CR3+, Então Cr (oh)2 É um agente redutor (perde um elétron para mudar para +3). Assim, embora ambos os hidróxidos possam ser obtidos como precipitados, o Cr (OH)3 -Também chamado de hidróxido crômico- é o composto predominante.
 Aparência de hidróxido de cromo
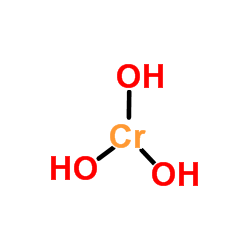
Aparência de hidróxido de cromo Ao contrário dos hidróxidos obtidos pela simples dissolução de óxidos metálicos na água, Cr (OH)3 Não é sintetizado por esta rota devido à baixa solubilidade do óxido crômico (CR2QUALQUER3, imagem superior). No entanto, cr (oh)3 É considerado o CR2QUALQUER3· Xh2Ou, usado como esmeralda verde pigmento (Guinet Green).
No laboratório, é baseado no cromo metálico, que é dissolvido em solução ácida para a formação do complexo [Cr (OH2)6]3+. Este complexo aquoso reage com uma base (NaOH ou KOH) para formar o hidróxido crômico correspondente.
Se as etapas anteriores forem realizadas em condições que garantem a ausência de oxigênio, a reação origina Cr (OH)2 (Hidróxido cromo). Posteriormente, é necessária uma separação e desidratação do sólido precipitado. Como resultado, o verdadeiro cr (oh) é "nascido"3, Um pó verde com uma estrutura polimérica e incerta.
[TOC]
Estrutura de hidróxido de cromo
A imagem superior é a representação mais simples de Cr (OH)3 na fase de gás e isolada. Também e assumindo o caráter puramente iônico de suas interações, nos cátions sólidos pode ser visualizado3+ interagindo com uma quantidade triplicada de ânions oh-.
Pode atendê -lo: absorção molarNo entanto, a natureza do link CR-OH é mais covalente, devido à química de coordenação de CR3+.
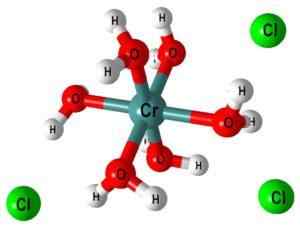
Por exemplo, o complexo [cr (oh2)6]3+ Indica que o centro do cromo metálico é coordenado com seis moléculas de água; Como estes são neutros, o complexo exibe a carga positiva do cátion original, CR3+.
Octaedro e polimerização
Na imagem superior, a estrutura do complexo [Cr (OH é representada2)6]3+. Íons cl- Eles podem vir, por exemplo, do ácido clorídrico no caso de ter sido usado para a dissolução de sal ou óxido crômico.
Quando Naoh (ou koh) é adicionado ao meio de reação, o íon OH- Uns uma molécula deste complexo, formando [cr (oh2)5(Oh)]2+ (Agora existem cinco moléculas de água porque o sexto perdeu um próton).
Consecutivamente, esse novo complexo desidrato para outro complexo aquoso, criando dímeros unidos por pontes de hidróxido:
(H2QUALQUER)5CR-OH-CR (OH2)5
À medida que a basicidade do meio aumenta (o pH ascende) o complexo [cr (oh2)4(OH)2]+, e também aumentar as probabilidades de novas pontes de hidróxido para criar geléia -polímeros. De fato, essa geléia "Grey -Green" se recusa a precipitar ordenar.
Finalmente, Cr (Oh2)3(OH)3 Consiste em um octaedro com o CR3+ No centro, e ligado a três moléculas de água e três oh- que neutralizam sua carga positiva; Isso sem considerar a polimerização.
Quando o CR (Oh2)3(OH)3 Está desidratado, a água coordenada com o CR é eliminada3+, E como esse cátion é coordenado com seis espécies (ligantes), surgem estruturas poliméricas nas quais os links de CR-CR estão envolvidos.
Pode servir a você: gordura butírica: obtenção, tipos, composição, usos, benefíciosAlém disso, quando desidratado, sua estrutura pode ser considerada de um tipo CR2QUALQUER3· 3h2QUALQUER; Em outras palavras, o de óxido crômico tri-hidratado. No entanto, são os estudos físico -químicos do sólido que podem esclarecer a verdadeira estrutura de Cr (OH)3 neste ponto.
Propriedades físicas e químicas do hidróxido de cromo
Cr (oh)3 Parece um pó azul verde-verde, mas quando entra em contato com a água, pois forma uma geléia verde acinzentada.
É insolúvel na água, mas solúvel em ácidos e bases fortes. Além disso, quando é aquecido, ele quebra, produzindo vapores de óxido cromo.
Anfoterismo
Por que o hidróxido de cromo é solúvel em soluções ácidas e básicas? O motivo é devido ao seu caráter anfóter, que permite que você reaja com ácidos e bases. Esta propriedade é característica de CR3+.
Ao reagir com ácidos, Cr (oh2)3(OH)3 É dissolvido porque as pontes hidroxila são quebradas, responsáveis pela junta de junta do precipitado.
Por outro lado, quando mais base é adicionada, oh- Eles continuam a substituir as moléculas de água, formando o complexo negativo [Cr (OH2)2(OH)4]-. Este complexo transforma a solução de uma cor verde clara, que se intensifica à medida que a reação continua.
Quando todo Cr (Oh2)3(OH)3 Você reagiu, um último complexo é obtido conforme indicado pela equação química:
Cr (Oh2)3(OH)3 + 3 Oh- [CR (OH)6] 3- + 3 h2QUALQUER
Este complexo negativo está associado aos cátions vizinhos (NA+, Se a base for Naoh) e após a evaporação da água, o sal de cromito de sódio (nacro2, cor verde esmeralda). Assim, tanto o ácido quanto o meio básico são capazes de dissolver o hidróxido de cromo.
Pode servir você: indianoSíntese de hidróxido de cromo no campo industrial
Na indústria, é produzido pela precipitação de sulfato de cromo com soluções de hidróxido de sódio ou hidróxido. Da mesma forma, o hidróxido de cromo é produzido por reação esquematizada:
Cro72- + 3 Então2 + 2h+ => 2 cr3+ + 3 Então42- + H2QUALQUER
Cr3+ + 3oh- => Cr (oh)3
Conforme mostrado no procedimento anterior, a redução do cromo VI ao Chrome III tem grande importância ecológica.
O Chromium III é relativamente inofensivo para a Biota, enquanto o Chromium VI é tóxico e carcinogênico, além de muito solúvel, de modo que sua eliminação do ambiente é de importância.
A tecnologia de tratamento de água e solo inclui uma redução de Cr (VI) para CR (III).
Formulários
O hidróxido de cromo tem várias aplicações:
- Formulação de maquiagem.
- Tinturas de cabelo.
- Esmalte.
- Produtos de cuidados com a pele.
- Produtos de limpeza.
- No acabamento metálico, que representa 73 % de seu consumo no setor.
- Na preservação da madeira.
Referências
- Whitten, Davis, Peck e Stanley. Química. (8ª ed.). Cengage Learning, p. 873, 874.
- PubChem. Hidróxido crômico. Recuperado de PubChem.NCBI.Nlm.NIH.Gov
- Síntese, caracterização e estabilidade dos hidróxidos de Cr (III) e Fe (III). Papassiopi, n., Vaxevanidou, k., Christou, c., Karagianni, e. e Antipas, G. J. Hazard Mater. 264: 490-497.
- Prebchem. Preparação de hidróxido de cromo (III). Recuperado de prepchem.com
- Wikipedia. (2018). Hidróxido de cromo (III). Recuperado de.Wikipedia.org