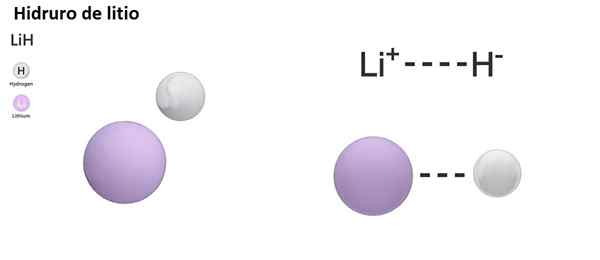Hidratantes
- 2945
- 221
- Terrell Stokes
O que são Hydruros?
Os hidros são compostos químicos que resultam da reação de hidrogênio com elementos metálicos (sódio, potássio, cálcio, etc.) e não metais (cloro, flúor, oxigênio, nitrogênio, carbono, etc.). O hidrogênio reage com quase todos os elementos químicos, de modo que os hidratantes são substâncias muito diversas.
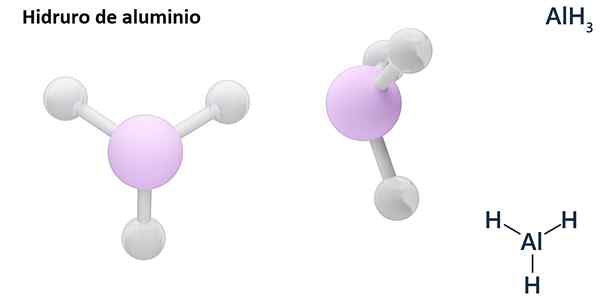
Suas fórmulas gerais podem ser do tipo MHn, Onde m é metal e n sua valência (+1, +2, +3), como hidreto de alumínio, Alh Alh3; ou do tipo EHn ou hnE, onde E é um elemento não metálico e n Sua valência, como NH3 ou h2S.
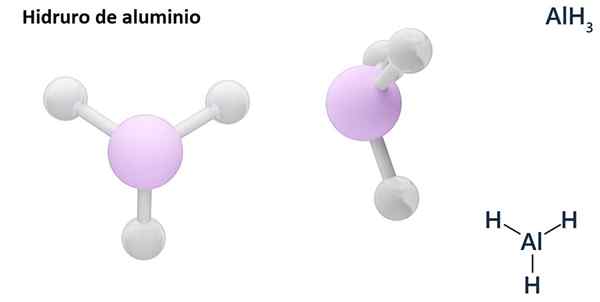
Os hidros são geralmente compostos binários, ou seja, resultam da combinação de hidrogênio com outro elemento químico. No entanto, o hidrogênio também pode estabelecer combinações com vários elementos químicos, para formar hidratantes mais complexos. Todos os hidratantes explicados serão binários, como Alh3 e nah.
Existem três tipos de hidratantes de acordo com a natureza de sua ligação química: iônica, molecular e metálica. Os hidratantes iônicos ou salinos são caracterizados pela presença de um vínculo iônico. Este link consiste na atração elétrica entre a carga positiva de um metal alcalino (NA+) ou alcalino-bujão (mg2+), e a carga negativa do ânion hidreto (H-).
Os hidretos moleculares, por outro lado, são caracterizados pela formação de uma ligação covalente entre hidrogênio e um elemento não -metálico. Entre os elementos não -metálicos que formam hidros estão: cloro, bromo, fluorina, iodo, oxigênio e nitrogênio.
E hidratantes de metal resultam da combinação de hidrogênio com alguns metais de transição. Esse tipo de hidreto, diferente dos anteriores, tem estruturas complexas e não será explicado aqui.
Propriedades de Hydros
As propriedades dos hidrões variam dependendo do tipo de hidreto: iônico, molecular ou metálico, de modo que suas propriedades devem ser indicadas separadamente.
Hidratantes iônicos ou salinos
São sólidos brancos cristalinos, mas devido à presença de impurezas, eles adquirem uma cor acinzentada. Esses hidretos não são solúveis em solventes comuns, como água, álcool, etc. Eles também têm pontos de ebulição e fusão altos.
Eles têm uma densidade de estado alta e derretida pode realizar eletricidade.
As hidurnas iônicas são consideradas básicas ou alcalinas, uma vez dissolvidas em hidróxido de água e liberam hidrogênio molecular:
Nah +h2O → h2 + Naoh
A reação do hidreto iônico com água é muito vigoroso e perigoso: produz hidrogênio em forma de gás, que é um material combustível e inflamável.
Hyndurns iônicos também podem reagir com halogenetos de metal, formados por um metal e um não -metal conhecido como halogênio (mx, x = f, cl, br, i):
Pode atendê -lo: dimetilanilina: estrutura, propriedades, síntese, usos4 lih +alcl3 → Lialh4 + 3 LiCl
LIH (hidreto de lítio) é um composto binário; Enquanto o Lialh4 (Lítio e hidreto de alumínio) é um composto ternário, ou seja, consiste em três elementos químicos.
Hidros moleculares ou covalentes
Eles estão em estado líquido ou gasoso, diferentemente dos hidratantes iônicos, que são sólidos. Eles têm baixos pontos de ebulição e fusão, observando que, aumentando o peso molecular do hidreto, o ponto de ebulição aumenta; Exceto pela amônia (NH3), Água (H2O) e hidreto de flúor (HF).
Hidretos covalentes são condutores de eletricidade pobres e muitas de suas propriedades são devidas à formação de pontes de hidrogênio. Os hidretos covalentes são considerados ácidos, pois dissolvidos em água podem causar ácidos, por exemplo, ácido clorídrico.
Hidratores de metal
Eles estão em estado sólido, apresentando o tom escuro dos metais. São bons condutores de eletricidade e têm superfícies lustrosas. Hidretos metálicos que são estáveis no ar tornam -se reagentes quando aquecem, por exemplo, hidreto de urânio (UH3) Apresente esta propriedade.
Nomenclatura
A maneira de nomear hidratantes é simples e não varia muito em nenhuma das nomenclaturas. Se o metal ou elemento metálico tiver mais de uma valência, é especificado entre parênteses e com número romano de acordo com a nomenclatura de ações.
Por exemplo, o Feh3 é chamado hidreto de ferro (iii) e coh2 Hydro cobalto (ii). Esses mesmos hidretos também podem ser nomeados usando a nomenclatura sistemática, que utiliza os números gregos (DI, TRI, TETRA, etc.). Assim, o Feh3 é chamado de tri -hidreto de ferro e coh2 di -hidruro cobalto.
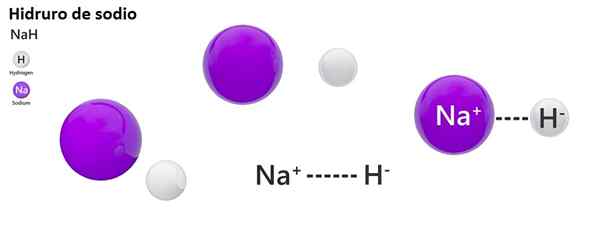
A nomenclatura clássica não é amplamente utilizada para hidros. Por exemplo, Nah é conhecido mais como hidreto de sódio, e não hidreto de sódio.
 Hidreto de sódio
Hidreto de sódio Como os hidros são formados?
Hidratantes iônicos ou salinos
Eles são formados pela reação de hidrogênio com um metal pertencente ao grupo de metais alcalinos ou ao grupo de metais alcalinos-terro.
Em hidratantes treinados com esses metais, o hidrogênio é encontrado na forma H-, conhecido como ânion hidreto.
Os metais alcalinos (lítio, sódio, potássio, rubídio e césio) reagem com hidrogênio para formar seus hidurnos correspondentes:
2 m (l)+h2(g) → 2mh (s)
Pode atendê -lo: operações da unidadeMetal m Quando a reação está em estado líquido e hidrogênio no estado gasoso, portanto a reação requer altas temperaturas e altas pressões. Considere o seguinte exemplo:
2 li (l) +h2 (g) → 2 lih (s)
A reação de hidrogênio com metais alcalinos (berílio, magnésio, cálcio, estrôncio e bário), para formação de hidreto, é semelhante à observada com metais alcalinos.
O magnésio e o berílio formam hidretos, mas seus vínculos com hidrogênio são do tipo covalente; Isto é, não -iônico, ao contrário de outros metais alcalinos:
CA (L) +H2 (g) → Cah2 (S)
Hidratores moleculares
O hidrogênio pode reagir com não -metais, correspondendo aos grupos 14, 15, 16 e 17 da tabela periódica, para formar hidratantes moleculares. Considere, por exemplo, a formação de hidreto de fluoreto por combinação ou mistura direta de hidrogênio com fluorina:
H2 (g) +f2 (g) → 2 hf (g)
A HF é conhecida mais como fluoreto de hidrogênio, mas também é chamado de hidreto de fluoreto.
Além disso, o hidrogênio pode reagir com oxigênio (grupo 16 da tabela periódica) seguindo o mesmo esquema:
2 h2 (g) +ou2 (g) → 2 h2O (G)
A reação requer suprimento de calor para produzir óxido de hidrogênio (água) ou hidreto de oxigênio.
Além disso, o hidrogênio pode reagir com nitrogênio, pertencente ao grupo 15 da tabela periódica para formar hidreto de nitrogênio, mais conhecido como amônia (NH3).
N2 (g) +3 h2 (g) → 2 NH3 (g)
A reação requer suprimento de calor, alta pressão e presença de catalisadores (eles aceleram reações químicas).
Hidratores de metal
Eles são formados pela reação dos metais de transição (grupos 3, 4, 5, 6, 10, 11 e 12 da tabela periódica) com hidrogênio. No entanto, os metais de transição dos grupos 7, 8 e 9 não formam compostos com hidrogênio, um fenômeno conhecido como hidreto de hidreto ou hidreto de lacuna.
Uma característica única dos hidratantes de metais de transição é que eles nem sempre apresentam uma proporção fixa entre o número de átomos de hidrogênio e o número de átomos presentes no hidreto. Isto é, suas fórmulas e estruturas não são simples de representar.
Usos/aplicações de hidros
 Hidros estão muito presentes em um dos muitos tipos de baterias: como o NIMH. Fonte: Multicherry, CC BY-SA 4.0, via Wikimedia Commons
Hidros estão muito presentes em um dos muitos tipos de baterias: como o NIMH. Fonte: Multicherry, CC BY-SA 4.0, via Wikimedia Commons Os hidros estão presentes nas baterias de hidreto metálico de níquel (NIMH), usadas em conjunto com metais de terras raras, cobalto ou manganês. Vários hidratantes de metal foram examinados para uso em carros elétricos acionados por células relacionadas a hidrogênio.
Pode servir a você: Método de Balax Redox: Etapas, Exemplos, ExercíciosAgentes redutores
Hidreto de lítio e boro de sódio (NABH4) Eles são usados como reações químicas em reações de síntese orgânica.
Armazenamento de hidrogênio e outros usos relacionados
Existem pilotos de uso de hidrogênio como combustível em veículos a motor, mas devido à sua explosividade, seu uso foi limitado como combustível. O uso de hidros foi proposto como uma forma de armazenamento de hidrogênio, para controlar seu perigo.
Além disso, os hidratantes têm sido usados para purificação e separação de sensores de hidrogênio e temperatura.
Desiclantes
O hidreto de cálcio é usado para remover a água presente em solventes orgânicos.
Ácidos se originou com hidratantes moleculares
Por exemplo: o ácido clorídrico é formado pela solução em um meio aquoso de hidreto de cloro (HCl), usando ácido clorídrico na eliminação de óxidos que cobrem ferro, a acidificação dos poços de óleo, a produção do cloreto de cálcio e tratamento mineral.
Fertilizantes
A amônia (NH3) É um hidreto usado como fertilizante líquido e serve para a síntese de compostos com nitrato de amônio e sulfato de amônio, que são usados como fertilizantes.
A água
É o hidreto mais importante. É usado em muitos setores com diferentes usos e aplicativos. A água é o principal responsável pela existência de seres vivos.
Exemplos de hidratantes
Finalmente, outros exemplos de hidratantes serão listados com suas respectivas fórmulas e nomes:
SNH4: hidreto de lata | PH3: hidreto de fósforo (fosfina) ou tri -hidreto de fósforo |
KH: hidreto de chumbo | MGH2: hidreto de magnésio ou di -hidruro de magnésio |
KH: hidreto de potássio | CH4: Carruro Carruro ou tetra -hidreto de carbono (metano) |
Cah2: hidreto de cálcio | Feh2: hidreto de ferro (ii) |
Nah: hidreto de sódio | ZnH2: hidreto de zinco |
LiH: hidreto de lítio | Bah2: hidreto de bário |
CSH: hidreto de césio | BH3: Boron Hydro (BAS |
Beh2: hidreto de di -hidreto beryl ou beril | SIH4: Hydro de silício (Silan) |
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wojes, Ryan. (27 de agosto de 2020). O que é um hidreto de metal? Recuperado de: pensamento.com
- Elementos americanos. (2020). Hidridides. Recuperado de: Americanments.com
- Wikipedia. (2020). Hidreto. Recuperado de: em.Wikipedia.org
- Tandis Arani. (15 de agosto de 2020). Hidridides. Química Librettexts. Recuperado de: química.Librettexts.org
- Os editores da Enyclopaedia Britannica. (2020). Hidreto. Recuperado de: Britannica.com