Estrutura da hidrolasase, funções, exemplos

- 696
- 57
- Terrence King IV
As Hidrolase São enzimas responsáveis por hidrolisando diferentes tipos de links químicos em muitos compostos diferentes. Entre os principais links que Hydrolyz estão o éster, links glucosídicos e peptídicos.
Dentro do grupo de hidrolases, mais de 200 enzimas diferentes foram classificadas, agrupadas pelo menos 13 conjuntos individuais; Sua classificação é essencialmente baseada no tipo de composto químico que serve como substrato.
 Modelagem gráfica com ferramentas bioinformáticas da estrutura de uma hidrolase (Fonte: Jawahar Swaminathan e MSD funcionários do Instituto Europeu de Bioinformática [domínio público] via Wikimedia Commons) via Wikimedia Commons)
Modelagem gráfica com ferramentas bioinformáticas da estrutura de uma hidrolase (Fonte: Jawahar Swaminathan e MSD funcionários do Instituto Europeu de Bioinformática [domínio público] via Wikimedia Commons) via Wikimedia Commons) As hidrolases são indispensáveis para a digestão dos alimentos no intestino dos animais, pois são responsáveis por degradar grande parte dos elos que compõem as estruturas carbonatadas dos alimentos que eles ingerem.
Essas enzimas funcionam em meios aquosos, pois precisam de moléculas de água ao seu redor para adicionar aos compostos assim que as moléculas forem divididas. Em palavras simples, as hidrolases realizam uma catálise hidrolítica dos compostos sobre os quais agem.
Por exemplo, quando uma hidrolase quebra uma ligação covalente C-C, o resultado geralmente é um grupo C-O e um grupo C-H.
[TOC]
Estrutura
Como muitas enzimas, as hidrolases são proteínas globulares organizadas em estruturas complexas que são organizadas através de interações intramoleculares.
Hidrolases, como todas as enzimas, se ligam a uma ou mais moléculas de substrato em uma região de sua estrutura conhecida como "local ativo". Este site é um bolso ou fenda cercada por muitos resíduos de aminoácidos que facilitam a aderência ou união do substrato.
Cada tipo de hidrolase é específico para um determinado substrato, que é determinado por sua estrutura terciária e pela formação de aminoácidos que tornam seu lugar ativo. Essa especificidade foi aumentada didaticamente por Emil Fischer como uma espécie de "chave e trava".
Pode atendê -lo: polimerase: características, estrutura e funçõesAtualmente, sabe -se que o substrato, em geral, induz mudanças ou distorções na formação de enzimas e que as enzimas, por sua vez, distorcem a estrutura do substrato para garantir que essa “renda” em seu local ativo.
Funções
Todas as hidrolases têm a principal função de quebrar ligações químicas entre dois compostos ou dentro da estrutura da mesma molécula.
Existem hidrolases para quebrar quase qualquer tipo de link: alguns degradam as ligações éster entre carboidratos, outras ligações peptídicas entre aminoácidos de proteína, outras ligações carboxílicas, etc.
O objetivo do processo de ligação química catalisado por uma enzima hidrolase varia consideravelmente. Smozyme, por exemplo, é responsável pela hidrólise de ligações químicas com fins de proteção do organismo que o sintetizam.
Essa enzima degrada os links que se mantêm juntos com os compostos na parede celular das bactérias, com o objetivo de proteger o corpo humano da proliferação bacteriana e uma possível infecção.
Nucleas são enzimas "fosfatase" que têm a capacidade de degradar os ácidos nucleicos, que também podem representar um mecanismo de defesa celular contra vírus de DNA ou RNA.
Outras hidrolases, como as do tipo "proteases", degradam as ligações peptídicas de proteínas no trato digestivo para tornar os aminoácidos assimiláveis no epitélio gastrointestinal.
Até as hidrolases estão envolvidas em vários eventos de produção de energia no metabolismo celular, uma vez que as fosfatases catalisam a liberação de moléculas de fosfato de substratos de alta energia, como o piruvato, na glicólise.
Pode servir você: aderência de sojaExemplos de hidrolasases
Entre a grande diversidade de hidrolases que os cientistas identificaram, alguns foram estudados com maior ênfase do que outros, pois estão envolvidos em muitos processos essenciais para a vida celular.
Entre estes estão a suavidade, a serina protease, a endonucleosa e a glucosidase ou as fosfatases glicosyraious.
A suavidade
Enzimas deste tipo quebra. Isso geralmente acaba causando uma lise total das bactérias.
Os Smozimes defendem o corpo de animais de infecções bacterianas e são abundantes em secreções corporais em tecidos que estão em contato com o meio ambiente, como, por exemplo, lágrimas, saliva e mucusidades.
O ovo de frango liso foi a primeira estrutura de proteína que cristalizou através de raios X. Esta cristalização foi feita por David Phillips, em 1965, no London Real Institute.
O local ativo desta enzima é composto pela asparagina-alanina-mecânica-peasparagina-glicina-glicina-peptídeo-metenina-metenina (NAM-NAG-NAM).
Protease serin
As enzimas deste grupo são responsáveis por hidrolisando ligações peptídicas em peptídeos e proteínas. Os mais estudados são trpsina e quimotripsina; No entanto, existem muitos tipos diferentes de proteases, que variam em relação à especificidade do substrato e seu mecanismo de catálise.
As "proteases" são caracterizadas por possuir um aminoácido nucleofílico do tipo serina. Proteasas Serin também é capaz de quebrar uma ampla variedade de links de éster.
Pode atendê -lo: qual é a composição química dos seres vivos?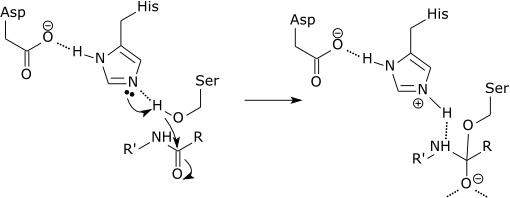 Esquema gráfico da ação de uma protease sendo quebrada um link peptídico no aminoácido histidina (fonte: Zephyris na Wikipedia da língua inglesa [CC BY-SA 3.0 (http: // criativecommons.Org/licenças/BY-SA/3.0/)] via Wikimedia Commons)
Esquema gráfico da ação de uma protease sendo quebrada um link peptídico no aminoácido histidina (fonte: Zephyris na Wikipedia da língua inglesa [CC BY-SA 3.0 (http: // criativecommons.Org/licenças/BY-SA/3.0/)] via Wikimedia Commons) Essas enzimas cortam peptídeos e proteínas de uma maneira inespecífica. No entanto, todos os peptídeos e proteínas a serem cortados devem ser ligados pela extremidade N-terminal do link peptídico ao local ativo da enzima.
Cada curta protease é precisamente a ligação Amida que se forma entre a extremidade C-terminal do aminoácido na extremidade carboxil e a amina de ácido amineo que está em direção à extremidade N-terminal do peptídeo.
Nuclease fosfatases
Essas enzimas catalogam. Existem muitos tipos diferentes dessas enzimas, pois são específicas para o tipo de ácido nucleico e o local de corte.
 Esquema gráfico da ação de uma endonuclease hidrolisando uma ligação fosfodiéster (Fonte: J3D3 [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons)
Esquema gráfico da ação de uma endonuclease hidrolisando uma ligação fosfodiéster (Fonte: J3D3 [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons) As endonucleases são indispensáveis no campo da biotecnologia, pois permitem que os cientistas modifiquem os genomas dos organismos cortando e substituindo fragmentos da informação genética de quase qualquer célula.
As endonucleases fazem o corte das bases nitrogenadas em três etapas. O primeiro é através de um aminoácido nucleofílico, então uma estrutura intermediária é formada com carga negativa que atrai o grupo fosfato e finalmente quebra o vínculo entre as duas bases.
Referências
- Davies, g., & Henrissat, B. (novecentos e noventa e cinco). Estruturas e mecanismos de glicosil hidrolas. Estrutura, 3 (9), 853-859.
- Lehninger, a. eu., Nelson, d. eu., Cox, m. M., & Cox, M. M. (2005). Lehninger Principles of Biochemistry. Macmillan.
- Mathews, a. P. (1936). Princípios de bioquímica. C. Madeira.
- Murray, r. K., Granner, d. K., Mayes, p., & Rodwell, V. (2009). Bioquímica ilustrada de Harper. 28 (p. 588). Nova York: McGraw-Hill.
- Ollis, d. eu., Cheeah, e., Cygler, m., Dijkstra, b., FOLOW, f., Franken, s. M.,… & Sussman, J. eu. (1992). A dobra α/β hidrolase. Proteína de Engenharia, Design e Seleção, 5 (3), 197-211.

