Hidrólise o que consiste e exemplos de reações
- 966
- 219
- Conrad Schmidt
O hidrólise É uma reação química que pode ocorrer em moléculas ou íons inorgânicos e orgânicos, e que envolve a participação da água para a quebra de seus títulos. Seu nome se origina do grego, 'hidro' de água e 'lise' de ruptura.
A molécula de água, h2Ou, estabelece um equilíbrio com os íons de sais ácidos e bases fracas, aparecendo pela primeira vez esse conceito em estudos gerais de química e em química analítica. É, portanto, uma das reações químicas mais simples.
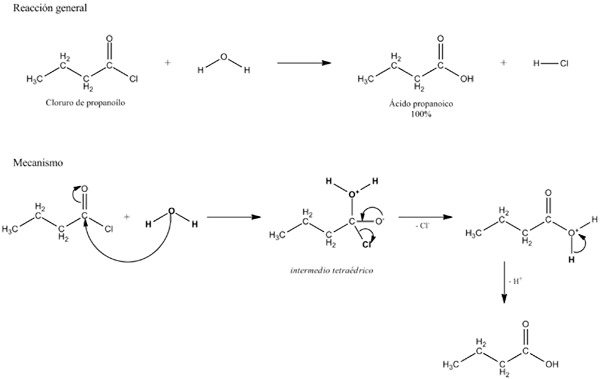
 Equação geral para uma reação de hidrólise. Fonte: Gabriel Bolívar.
Equação geral para uma reação de hidrólise. Fonte: Gabriel Bolívar. Em vários exemplos de hidrólise, a água sozinha é incapaz de quebrar uma certa vínculo covalente. Quando isso ocorre, o processo acelera ou catalisa por acidificação ou alcalização do meio; isto é, na presença de íons h3QUALQUER+ ou oh-, respectivamente. Também existem enzimas que catalisam a hidrólise.
A hidrólise ocupa um lugar especial em termos de biomoléculas, uma vez que os vínculos que mantêm seus monômeros juntos são suscetíveis ao hidrolisar sob certas condições. Por exemplo, os açúcares são hidrolisados para decompor polissacarídeos em seus monossacarídeos constituintes graças à ação das enzimas da glucosidase.
[TOC]
O que é hidrólise?
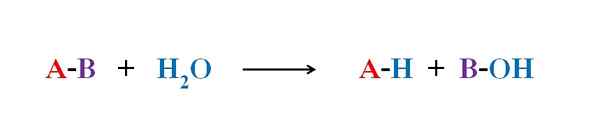
A imagem superior explica o que a hidrólise consiste em. Observe que não apenas a molécula ou substrato (se mediar as enzimas) quebra seu vínculo, mas também a própria água, que é "fratura" em H+ e oh-, Onde h+ termina com A e Oh- com B. A-B reage com uma molécula de água originando dois produtos, a-h e b-oh.
A hidrólise é, portanto, a reação contrária à condensação. Na condensação, dois produtos, para dizer A-H e B-OH, estão vinculados pela liberação de uma pequena molécula: água. Na hidrólise, uma molécula é consumida, enquanto em condensação é liberada ou produzida.
Pode servir a você: Grupo Carbonil: Características, Propriedades, Nomenclatura, ReatividadeVoltando ao exemplo de açúcares, suponha que o A-B corresponda a um dímero de sacarose, onde ele representa glicose e b frutose. O link A-B, glucosídico, pode hidrolizar-se para originar os dois monossacarídeos separadamente e em solução, e o mesmo acontece com o oligo e os polissacarídeos se mediarem enzimas em tais reações.
Observe que, nesta reação, a de A-B, a seta tem apenas um endereço; isto é, é uma hidrólise irreversível. No entanto, muitas hidrólise são de fato reações reversíveis que atingem um equilíbrio.
Exemplos de reações de hidrólise
- ATP
O ATP é estável entre os valores de pH de 6,8 e 7,4. No entanto, em valores extremos de pH, é espontaneamente hidrolisado. Nos seres vivos, a hidrólise é catalisada por enzimas conhecidas como Atasas:
ATP +H2O => ADP +PI
Essa reação é fortemente exercitada, uma vez que a entropia de ADP é maior que a de ATP. A variação de energia livre de Gibbs (ΔGº) é - 30,5 kJ/mol/mol. A energia produzida pela hidrólise ATP é usada em inúmeras reações de eargon.
Reações acopladas
Em alguns casos, a hidrólise de ATP é usada para a conversão de um composto em um composto (b).
A +ATP +H2Ou B +ADP +PI +H+
- Água
Duas moléculas de água podem reagir entre si em uma hidrólise aparente:
H2Ou + h2Ou h3QUALQUER+ + Oh-
É como se uma dessas moléculas de água fraturadas em H+ e oh-, vou vincular o h+ Para o átomo de oxigênio da outra molécula de água, que causa o íon hidrium, h3QUALQUER+. Essa reação, mais que hidrólise, é sobre a autoropotólise da água.
Pode atendê -lo: energia de ativação- Proteínas
As proteínas são macromoléculas estáveis e, para alcançar sua hidrólise completa, nos aminoácidos que as constituem, são necessárias condições extremas; como uma concentração de ácido clorídrico (6 m) e altas temperaturas.
No entanto, os seres vivos são dotados de um arsenal enzimático que permite a hidrólise de proteínas em aminoácidos no duodeno. As enzimas envolvidas na digestão das proteínas são quase completamente secretadas pelo pâncreas.
Existem enzimas exopeptidase que degradam proteínas, começando em suas extremidades: aminopeptidase através da extremidade amino e carboxipeptidase através da extremidade carboxil. As enzimas endopeptidase exercem sua ação dentro da cadeia de proteínas, por exemplo: tripsina, pepsina, quimotripsina, etc.
- Amidas e ésteres
As amidas quando aquecidas em um meio alcalino originam um ácido carboxílico e uma amina:
RCONH2 + H2O => rcoo- + NH2
Os abatos em um meio aquoso são hidrolisados em um ácido carboxílico e álcool. O processo é catalisado por uma base ou um ácido:
Rco-ou ' +h2O => rcooh +r'oh
Esta é a famosa reação de saponificação.
- Base ácida
Na água, várias espécies são hidrolisadas para acidificar ou alcalizar o ambiente aquoso.
Adição de um sal básico
Acetato de sódio, um sal básico, dissocia -se em água dando íons Na+ (sódio) e Cho3COO- (acetato). Sua basicidade é porque o acetato é hidrolisado para gerar íons oh-, Enquanto o sódio permanece inalterado:
CH3COO- + H2Ou cap3COOH +OH-
Pode atendê -lo: metil salicilatoOH- Ele é responsável pelo pH para aumentar e se tornar básico.
Adição de um sal ácido
Cloreto de amônio (NH4Cl) é formado pelo íon cloreto (Cl-) do ácido clorídrico (HCl), um ácido forte e o cátion de amônio (NH4+) do hidróxido de amônio (NH4Oh), uma base fraca. O cl- Não se dissocia na água, mas o cátion de amônio é transformado na água da seguinte maneira:
NH4+ + H2Ou NH3 + H3QUALQUER+
A hidrólise do cátion de amônio produz prótons que aumentam a acidez de um meio aquoso, portanto conclui -se que o NH4Cl é um sal ácido.
Adição de um sal neutro
O cloreto de sódio (NaCl) é um produto de sal da reação de uma base forte (NaOH) com um ácido forte (HCl). Ao dissolver o cloreto de sódio na água, o cátion de sódio é produzido (Na+) e o ânion (CL-). Ambos os íons não se dissociam na água, então não adicionam h+ ou oh-, Mantendo seu pH constante.
Portanto, diz -se que o cloreto de sódio é um sal neutro.
Referências
- Mathews, c. K., Van holde, k. E. E Ahern, k. G. (2002). Bioquímica. (Terceira edição). Editar. Pearson-Addison Wesley.
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Helmestine, Anne Marie, Ph.D. (13 de janeiro de 2019). Hidrólise: Definição e Exemplo. Recuperado de: pensamento.com
- Theresa Phillips. (28 de abril de 2019). Uma explicação do processo de hidrólise. Recuperado de: Thealance.com
- Os editores da Enyclopaedia Britannica. (16 de novembro de 2016). Hidrólise. Encyclopædia britannica. Recuperado de: Britannica.com
- Wikipedia. (2019). Hidrólise. Recuperado de: em.Wikipedia.org
- « Características de Hyracotherium, Nutrição, Espécies, Reprodução
- History of Origins Video Games to Virtual Reality »

