Halogênios
- 1510
- 147
- Terrence King IV
 Os elementos são 5: fluoreto, cloro, bromo, iodo e reafirmar
Os elementos são 5: fluoreto, cloro, bromo, iodo e reafirmar O que são halogênios?
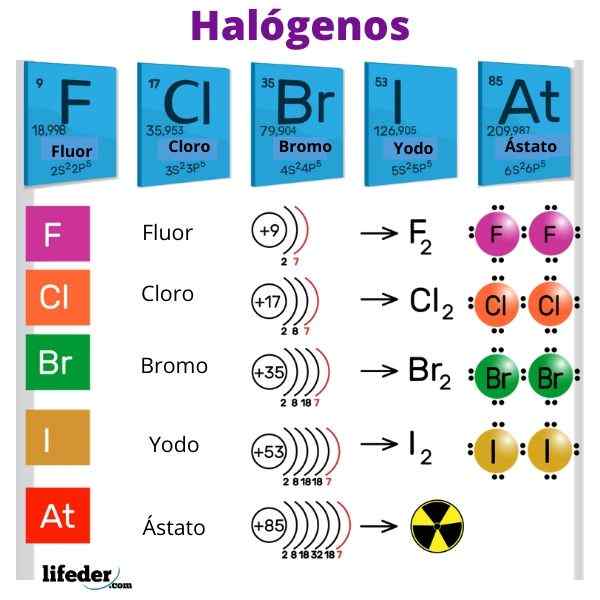
O halogênios São elementos não metálicos que pertencem ao grupo VIIA ou 17 da tabela periódica. Eles têm altos eletronegatividades eletrônicas e afinidades, que afetam muito o caráter iônico de seus laços com metais. A palavra 'halogenos' é de origem grega e significa "sais de sais".
Os halogênios são fluoreto (F), cloro (CL), bromo (Br), iodo (i) e o elemento radioativo e efêmero Ástato (AT). Eles são tão reativos que reagem entre si para formar moléculas diatômicas: f2, Cl2, Br2, Yo2 e em2.
Essas moléculas são caracterizadas por ter propriedades estruturais semelhantes (moléculas lineares), embora com diferentes estados físicos.
Qual é a aparência dos halogênios?
Na imagem inferior, três halogênios são mostrados. Da esquerda para a direita: cloro, bromo e iodo. Nem Fluorine nem Janteate podem ser armazenados em recipientes de vidro, pois este não resiste à sua corrosividade. Observe como as propriedades organolépticas dos halogênios mudam à medida que seu grupo é descendente ao elemento iodo.
 Aparência de halogênios. Fonte: Fonte: por w. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)], via Wikimedia Commons
Aparência de halogênios. Fonte: Fonte: por w. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)], via Wikimedia Commons A fluorina é um gás de tons amarelados; Cloro também, mas verde-amarelo; Bromo é um líquido avermelhado escuro; O iodo, um sólido preto com visões violeta; E o astat, um sólido metálico escuro e brilhante.
Os halogênios são capazes de reagir com quase todos os elementos da tabela periódica, mesmo com alguns gases nobres (como Xenon e Kripton). Quando o fazem, podem oxidar átomos em seus estados de oxidação mais positivos, tornando -os agentes oxidantes poderosos.
Da mesma forma, eles fornecem propriedades específicas às moléculas quando alguns de seus átomos estão ligados ou substituídos. Esses tipos de compostos são chamados de haluros. De fato, Haluros constitui a principal fonte natural de halogênios, e muitos deles são dissolvidos no mar ou fazem parte de um mineral; Esse é o caso do fluorito (CAF2).
Halogênios e Haluros têm uma ampla gama de usos, desde industriais ou tecnológicos, para simplesmente destacar o sabor de certos alimentos, como o sal da gema (cloreto de sódio) (cloreto de sódio).
Propriedades físicas e químicas de halogênios
Pesos atômicos
Fluoreto (F) 18,99 g/mol; Cloro (Cl) 35,45 g/mol; Bromo (BR) 79,90 g/mol; Iodo (i) 126,9 g/mol e astato (at) 210 g/mol.
Estado físico
F gás; CL gasoso; Líquido; Eu sólido e sólido.
Cor
F, grita amarela pálida; Cl, verde pálido; Br, marrom-avermelhado; Eu, violeta e at, preto metálico * * (assumido)
Pontos de fusão
F -219,6º C; Cl -101,5º C; Br -7,3º c; I 113,7º C e a 302º C.
Pontos de ebulição
F -118.12º C; Cl -34,04º C; Br 58,8º C; I 184,3º C e ?A 337º c.
Densidade a 25º C
F-0,0017 g/cm3; CL- 0,0032 g/cm3; BR-3.102 g/cm3; I- 4,93 g/cm3 e AT- 6.2-6,5 g/cm3
Solubilidade em água
CL- 0,091 mmol/cm3; BR-0,21 mmol/cm3 e I- 0,0013 mmol/cm3.
Energia de ionização
F- 1.681 kJ/mol; Cl- 1.251 kJ/mol; BR-1.140 kJ/mol; I- 1.008 kJ/mol e 890 kJ/mol.
Eletro-negatividade
F-4.0; Cl- 3,0; 2,8; I- 2,5 e at-2,2.
Os halogênios têm 7 elétrons em sua camada de valência, daí sua grande avidez para ganhar um elétron. Além disso, os halogênios têm alta eletronegatividade devido aos seus pequenos rádios atômicos e à grande atração que o núcleo nos elétrons de Valência exerce.
Pode atendê -lo: lei de ação em massaReatividade
Os halogênios são altamente reativos, o que explicaria sua toxicidade. Além disso, eles são agentes oxidantes.
A ordem decrescente de reatividade é: f> cl> b> i> em.
Estado na natureza
Devido à sua grande reatividade, os átomos de halogênio não são de natureza livre, mas estão formando agregados ou como moléculas diatômicas ligadas por ligações covalentes.
Estruturas moleculares
Os halogênios não existem na natureza como átomos elementares, mas como moléculas diatômicas. No entanto, todos eles têm em comum uma estrutura molecular linear, e a única diferença está no comprimento de seus links e em suas interações intermoleculares.
As moléculas lineares X-X (x2) Eles são caracterizados por serem instáveis, porque ambos os átomos atraem fortemente o par de elétrons para eles. Porque? Porque seus elétrons externos experimentam uma carga nuclear eficaz muito alta, Zef. Um Zef importante, menos será a distância do link X-X.
À medida que o grupo desce, Zef se torna mais fraco e a estabilidade dessas moléculas aumenta. Assim, a ordem decrescente de reatividade é: f2> Cl2> Br2> I2. No entanto, é incongruente comparar o ostado com o fluorino, pois é desconhecido isótopo.
Interações intermoleculares
Por outro lado, suas moléculas não têm um momento dipolar, sendo apolar. Esse fato é responsável por suas fracas interações intermoleculares, cuja única força latente é dispersão ou Londres, que é proporcional à massa atômica e à área molecular.
Dessa forma, a pequena molécula de f2 não tem massa ou elétrons suficientes para formar um sólido. Ao contrário de i2, A molécula de iodo, que, no entanto, continua a ser um sólido que emite vapores roxos.
Bromo representa um exemplo intermediário entre as duas extremidades: BR moléculas2 Eles interagem o suficiente para aparecer em um estado líquido.
O reafirmar, provavelmente devido ao seu crescente caráter metálico, não se apresenta como em2 mas como átomos de atos formando links de metal.
Em relação às suas cores (amarelo amarelo-amarelo-vermelho-mudad-negro), a explicação mais apropriada é baseada na teoria orbital molecular (TOM). A distância energética entre o último orbital molecular completo e o próximo de maior energia (antienlace) é excedido pela absorção de um fóton com comprimentos de onda cada vez mais grandes e maiores.
Haluros
Os halogênios reagem para formar haluros, seja inorgânico ou orgânico. Os mais conhecidos são os halogenetos de hidrogênio: fluoreto de hidrogênio (IC), cloreto de hidrogênio (HCL), brometo de hidrogênio (HBR) e iodeto de hidrogênio (HI).
Todos eles dissolvidos em água geram soluções de ácido; Tão ácido, que HF pode degradar qualquer recipiente de vidro. Além disso, os materiais de partida são considerados para a síntese de ácidos extremamente fortes.
Existem também os halogenetos de meta. Por exemplo, os halogenetos de metais alcalinos têm fórmula MX e, entre eles, estão: NaCl, cloreto de sódio; KBr, brometo de potássio; LCF, fluoreto de césio; e lii, iodeto de lítio.
Os metais alcalinotherrosos, metais de transição ou metais do bloco P têm uma fórmula MXn, N sendo a carga de metal positiva. Assim, alguns exemplos deles são: FECL3, tricloreto férrico; Mgbr2, brometo de magnésio; Alf3, Trifluoruro de alumínio; e cui2, Iodeto cúprico.
Pode servir a você: sulfato de potássio (K2SO4): estrutura, propriedades, usos, sínteseNo entanto, os halogênios também podem formar vínculos com átomos de carbono; Portanto, eles podem interferir no mundo complexo da química orgânica e na bioquímica. Esses compostos são chamados halogenetos orgânicos e geralmente são fórmulas químicas, sendo x qualquer um dos halogênios.
Aplicações de usos/halogênio
Cloro
Na indústria
-Bromo e cloro são usados na indústria têxtil para branquear e tratar a lã, evitando assim o seu encolhimento ao se molhar.
-É usado como desinfetante de ditrito e para a purificação de água potável e piscinas. Além disso, compostos derivados de cloro são usados em lavanderias e na indústria de papel.
-Encontre uso na fabricação de baterias especiais e hidrocarbonetos clorados. Também é usado no processamento de carne, legumes, peixes e frutas. Além disso, o cloro funciona como um agente bactericida.
-É usado para limpar e descartar couro, e para branquear celulose. Anteriormente, o tricloreto de nitrogênio era usado como liquidificador e condicionador de farinha.
-Gas de fosfeno (cocl2) É usado em vários processos de síntese industrial, bem como na fabricação de gases militares. O fosfano é muito tóxico e é responsável por inúmeras mortes na Primeira Guerra Mundial, onde o gás foi usado.
-Este gás também é encontrado em inseticidas e fumigantes.
-NACL é um sal muito abundante que é usado para temperar os alimentos e na conservação de carnes de gado e pássaro. Além.
Em medicina
-Átomos de halogênio que se ligam aos medicamentos os tornam mais lipofílicos. Isso permite que os medicamentos passem por mais facilmente membranas celulares se dissolvendo nos lipídios que o formam.
-O cloro é disseminado no interior dos neurônios do sistema nervoso central através de canais iônicos ligados aos receptores GABA do neurotransmissor, produzindo um efeito sedativo. Este é o mecanismo de ação de várias ansiolíticas.
-O HCL está presente no estômago, onde intervém criando um ambiente redutor que favorece o processamento de alimentos. Além disso, o HCl ativa a pepsina, uma enzima que inicia a hidrólise das proteínas, um estágio anterior à absorção intestinal do material proteico.
Outros
-O ácido clorídrico (HCL) é usado na limpeza dos banheiros, em laboratórios de ensino e pesquisa e em várias indústrias.
-PVC (cloreto de polivinil) é um polímero de cloreto de vinil usado em roupas, pisos para pisos, cabos elétricos, tubos flexíveis, tubos, estruturas infláveis e telhas. Além disso, o cloro é usado como intermediário na elaboração de outros materiais plásticos.
-O cloro é usado na extração de bromo.
-O cloreto de metila cumpre uma função anestésica. Também é usado na elaboração de certos polímeros de silicone e na extração de gorduras, óleos e resinas.
-Clorofórmio (CHCL3) é um solvente usado em muitos laboratórios, especialmente em laboratórios de química orgânica e bioquímica, desde o ensino até os pesquisadores.
-E, finalmente, com relação ao cloro, o tricloroetileno é usado para degradar peças de metal.
Bromo
-O Bromo é usado no processo de extração de mineração de ouro e na perfuração de poços de petróleo e gás. É usado como retardador de combustão nas indústrias de plástico e gás. Bromo isola o fogo de oxigênio, fazendo com que ele desative.
Pode atendê -lo: metabisulfito de sódio (Na2S2O5): estrutura, propriedades, usos, riscos-É um intermediário na fabricação de fluidos hidráulicos, agentes refrigerantes e desumidificadores e preparados para moldar o cabelo. O brometo de potássio é usado na fabricação de placas e papéis fotográficos.
-O brometo de potássio também é usado como anticonvulsivo, mas devido à possibilidade de que o sal possa causar disfunções neurológicas, seu uso foi reduzido. Além disso, outro de seus usos comuns é como uma pílula para amostras sólidas de espectroscopia infravermelha.
-Os compostos de bromo estão presentes nos medicamentos usados no tratamento de pneumonia. Da mesma forma, os compostos de bromo são incorporados aos medicamentos usados nos testes que são realizados no tratamento da doença de Alzheimer.
-O Bromo é usado para reduzir a poluição do mercúrio em usinas elétricas que usam carvão como combustível. Também é usado na indústria têxtil para criar diferentes corantes de cores.
-O brominato de metila foi usado como pesticida para fumigação de solo e casas, mas seu efeito prejudicial no ozônio limitou seu uso.
-As lâmpadas de halogênio são incandescentes e o agregado de pequenas quantidades de bromo e iodo permite uma redução no tamanho das lâmpadas.
Iodo
-O iodo intervém no funcionamento da glândula tireóide, hormônio regulatório do metabolismo do corpo. A glândula tireóide se secreta os hormônios T3 e T4, que exercem sua ação em seus órgãos brancos. Por exemplo, a ação hormonal no músculo cardíaco causa um aumento na pressão arterial e na freqüência cardíaca.
-Da mesma forma, o iodo é usado na identificação da presença de amido. Silver Yoduro é um reagente usado na revelação das fotografias.
Flúor
-Alguns compostos de flúor são adicionados a pastas dentárias para evitar a aparência de cárie. Os derivados de flúor estão presentes em vários anestésicos. Na indústria farmacêutica, eles incorporam fluoreto aos medicamentos para estudar possíveis melhorias em seus efeitos no corpo.
-O ácido fluorérico é usado para gravar vidro. Também na produção de halons (gases extintores de incêndio, como o Fry). Um composto de flúor é usado na eletrólise de alumínio para alcançar sua purificação.
-Os revestimentos anti -referenciosos contêm um composto de flúor. Isso é usado na fabricação de telas plasmáticas, telas planas e sistemas microeletromecânicos. A fluorina também está presente na argila usada em alguma cerâmica.
Reafirmar
Pensa -se que o reafirme possa contribuir para o iodo na regulação do funcionamento da glândula tireóide. Além disso, seu isótopo radioativo (210Em) tem sido usado em estudos de câncer em ratos.
Referências
- Enciclopédia de saúde e segurança no trabalho. Halogênios e seus compostos. [PDF]. Tirado de:
- emprego.GO.é
- Química Librettexts. Grupo 17: Propriedades gerais de halogênios. Tirado de: química.Librettexts.org
- Wikipedia. (2018). Halogênio. Retirado de: em.Wikipedia.org
- Jim Clark. (Maio de 2015). Propriedades atômicas e físicas dos elementos do grupo 7 (os halogênios). Retirado de: Chemguide.co.Reino Unido
- Whitten, k. C., Davis, r. E., Peck, m. eu. E Stanley, G. G. Química (2003), 8ª ed. Cengage Learning.
- Unid. Halogênios. Retirado de: Elementos.org.é
- Brown, Laurel. (24 de abril de 2017). Características de halogênio. Cienting. Recuperado de: cienting.com

