Características de glutation, estrutura, funções, biossíntese
- 3750
- 300
- Tim Mann
Ele Glutation (GSH) É uma pequena molécula de tripéptida (com apenas três resíduos não -proteínas) que participa de muitos fenômenos biológicos, como mecânica enzimática, biossíntese de macromoléculas, metabolismo intermediário, toxicidade de oxigênio, transporte intracelular etc.
Este pequeno peptídeo, presente em animais, em plantas e em algumas bactérias, é contemplado como um "amortecedor" óxido-redutor, pois é um dos principais compostos de baixo peso molecular que contém enxofre e carece de toxicidade associada aos resíduos de cisteína.
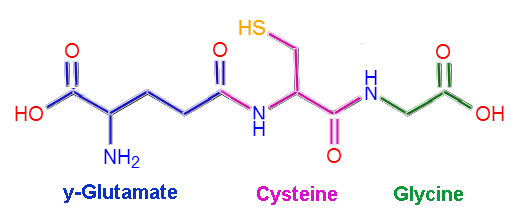
 Estrutura molecular da glutationa (Fonte: Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons)
Estrutura molecular da glutationa (Fonte: Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons) Algumas doenças em seres humanos têm sido associadas à deficiência de enzimas específicas do metabolismo da glutationa, e isso se deve às suas múltiplas funções na manutenção da homeostase do corpo.
A desnutrição, o estresse oxidativo e outras patologias sofridas por seres humanos podem ser evidenciados como uma diminuição drástica na glutationa, por isso às vezes é um bom indicador do estado de saúde dos sistemas corporais.
Para as plantas, da mesma maneira, a glutationa é um fator indispensável para seu crescimento e desenvolvimento, pois também cumpre as funções em várias vias biossintéticas e é essencial para a desintoxicação celular e a homeostase interna, onde atua como um poderoso antioxidante.
[TOC]
Caracteristicas
Os primeiros estudos realizados em relação à localização subcelular da glutationa demonstraram que está presente nas mitocôndrias. Posteriormente, também foi observado na região correspondente à matriz nuclear e em peroxissomos.
Atualmente, sabe -se que o compartimento em que sua concentração é mais abundante está em citosol, uma vez que é produzido e transportado ativamente para outros compartimentos celulares, como as mitocôndrias.
Nas células de mamíferos, a concentração de glutationa está na faixa de milimoles, enquanto no plasma sanguíneo sua forma reduzida (GSH) é encontrada em concentrações micromolares.
Essa concentração intracelular se assemelha à concentração de glicose, potássio e colesterol, elementos indispensáveis para estrutura celular e metabolismo.
Alguns organismos têm moléculas analógicas ou variantes de glutationa. Os parasitas protozoários que afetam os mamíferos têm uma forma conhecida como "tripanotion" e, em algumas bactérias, esse composto é substituído por outras moléculas sulfurizadas, como tiossulfato e glutamilcisteína.
Certas espécies de plantas têm, além da glutationa, moléculas homólogas que têm outros resíduos além da glicina no final do terminal C (homoglutação) e que são caracterizados por apresentar funções semelhantes às do tripéptide em questão.
Apesar da existência de outros compostos semelhantes à glutationa em diferentes organismos, este é um dos "tiíolos" que está em maior concentração intracelularmente.
A alta relação que normalmente existe entre a forma reduzida (GSH) e a forma oxidada (GSSG) da glutation é outra característica distinta dessa molécula.
Estrutura
A gutation ou L-Alemman-Glutamil-Cisteinil-glicina, como o nome indica, é composto por três resíduos de aminoácidos: L-glutamato, L-cisteína e glicina. Os resíduos de cisteína e glicina se ligam entre si por meio de ligações peptídicas comuns, isto é, entre o grupo α-carboxil de um aminoácido e o grupo α-amino do outro.
No entanto, a ligação entre glutamato e cisteína não é típica da proteína, pois ocorre entre a porção γ-carboxil do grupo r do glutamato e o grupo α-amino da cisteína, então esse link é chamado γ link.
Esta pequena molécula tem uma massa molar de pouco mais de 300 g/mol e a presença do link γ parece ser crucial para a imunidade desse peptídeo contra a ação de muitas enzimas aminopeptidase.
Pode atendê -lo: solidariedade entre espéciesFunções
Como mencionado, a glutationa é uma proteína que participa de numerosos processos celulares de animais, plantas e certos procariontes. Nesse sentido, sua participação geral pode ser destacada em:
-Processos de síntese e degradação proteica
-A formação de precursores de ribonucleotídeo de DNA
-A regulação da atividade de algumas enzimas
-A proteção das células na presença de espécies reativas de oxigênio (ERO) e outros radicais livres
-Transdução de sinal
-Expressão genética e em
-Apoptose de células programadas ou morte
Coenzima
Também foi determinado que a glutationa funciona como coenzima em muitas reações enzimáticas, e que parte de sua importância está relacionada ao que tem a capacidade de transportar aminoácidos na forma de aminoácidos γ-glutamil intacelularmente.
A glutation que pode deixar a célula (o que o faz em sua forma reduzida) é capaz de participar de reações de redução de óxido nas proximidades da membrana plasmática e do ambiente celular circundante, que protege células de dano diante de diferentes tipos de agentes oxidantes.
Armazenamento de cisteína
Este Tripéptido também funciona como fonte de armazenamento de cisteína e contribui para a manutenção do estado reduzido dos grupos proteínas sulfidhil dentro do grupo Hemo do grupo Hemo das proteínas que contêm o referido cofator.
Dobramento de proteínas
Ao participar do dobramento de proteínas, parece ter uma função importante como um agente redutor de pontes dissulfeto que foram formadas inadequadamente em estruturas de proteínas, o que geralmente se deve à exposição a agentes oxidantes, como oxigênio, peróxido de hidrogênio, peroxinitrito e alguns superóxidos.
Função em eritrócitos
Nos eritrócitos, a glutationa reduzida (GSH) produzida pela enzima redutase glutation peroxidase, que produz água oxidada e glutationa (GSSG).
A decomposição do peróxido de hidrogênio e, portanto, a prevenção de seu acúmulo em eritrócitos, prolonga o tempo de vida dessas células, uma vez que evita o dano oxidativo que pode ocorrer na membrana celular e que pode terminar em hemólise.
Metabolismo xenobiótico
A glutation também é um protagonista importante no metabolismo xenobiótico, graças à ação da enzima da glutationa S-transfereful que gera conjugados de glutationa que podem ser metabolizados intracelularmente.
É sensato.
Estado oxidativo das células
Como a glutationa existe em duas formas, uma reduzida e uma oxidada, a relação entre ambas as moléculas determina o estado redox das células. Se a proporção GSH/GSSG for maior que 100, as células serão consideradas saudáveis, mas se estiver perto de 1 ou 10, pode ser um indicador de que as células estejam em estado de estresse oxidativo.
Biossíntese
A glutatia do tripideide é sintetizada dentro do celular, tanto plantas quanto animais, pela ação de duas enzimas: (1) a γ-glutamilcistina sintetase e (2) a glutationa da sintetase (GSH sintetase), enquanto sua degradação ou "decomposição" depende da ação da ação da enzima γ-glutamil transpeptidase.
Nos organismos vegetais, cada uma das enzimas é codificada por um único gene e defeitos em qualquer uma das proteínas ou seus genes codificadores podem causar letalidade nos embriões.
Pode atendê -lo: filogeniaNo ser humano, como em outros mamíferos, o principal local de síntese e exportação de questão de glutation.
Síntese de Novo de glutationa, sua regeneração ou reciclagem, requer energia do ATP para ocorrer.
Glutationa reduzida (GSH)
A glutation reduzida deriva dos aminoácidos glicina, glutamato e cisteína, como já mencionado, e sua síntese começa com a ativação (usando ATP) do grupo γ-carboxil de glutamato (do grupo r) para formar um intermediário intermediário de fosfato de acil,, que é atacado pelo grupo α-amino da cisteína.
Esta primeira reação de condensação de dois aminoácidos é catalisada pela γ-glutamilcisteína sintetase e geralmente é afetada pela disponibilidade intracelular dos aminoácidos glutamato e cisteína.
O dipéptide assim formado é posteriormente condensado com uma molécula de glicina graças à ação da sintetase GSH. Durante essa reação, uma ativação de ATP do grupo α-carboxil da cisteína também ocorre para formar um acil de fosfato e, assim, favorece a reação com o resíduo de glicina.
Glutationa oxidada (GSSG)
Quando a glutationa reduzida participa de reações de redução de óxido, a forma oxidada é na verdade composta de duas moléculas de glutationa ligadas uma à outra através de pontes de dissulgação; É por esse motivo que a forma enferrujada é abreviada com o acrônimo "gssg".
A formação de espécies oxidadas de glutationa depende de uma enzima conhecida como mas peroxidase ou peroxidase GSH, que é uma peroxidase que contém uma selenocisteína (um resíduo de cisteína que, em vez de ter um átomo de suturina tem um de selênio) em seu seu coloque ativo.
A interconversão entre formas oxidadas e reduzidas é dada graças à participação de uma GSSG redutase ou Glutathion.
Benefícios da sua ingestão
A glutation pode ser administrada oral, tópica, intravenosa, intranasal ou nebulizada, a fim de aumentar sua concentração sistêmica em pacientes que sofrem de estresse oxidativo, por exemplo.
Câncer
As investigações realizadas em relação à administração de glutation oral sugerem que sua ingestão pode reduzir os riscos da condição de câncer bucal e isso, administrado junto com quimioterapêuticos oxidativos, reduz os efeitos negativos da terapia em pacientes com câncer.
HIV
Geralmente, os pacientes infectados com o vírus da imunodeficiência adquirida (HIV) apresentam deficiências intracelulares de glutationa, tanto em glóbulos vermelhos quanto em células T e monócitos, que condicionam seu funcionamento correto.
Em um estudo realizado por Morris e colaboradores, foi demonstrado que o fornecimento de glutationa para macrófagos de pacientes positivos para HIV melhorou bastante a função dessas células, especialmente diante de infecções com patógenos oportunistas, como M. tuberculose.
Atividade muscular
Outros estudos têm a ver com a melhoria da atividade contrátil dos músculos, defesa antioxidante e danos oxidativos causados em resposta à isquemia/reperfusão lesões após a administração oral do GSH durante o treinamento de resistência física.
Patologias hepáticas
Foi considerado, por sua vez, que sua ingestão ou administração intravenosa tem funções na prevenção do progresso de alguns tipos de câncer e na redução de danos celulares que ocorrem como resultado de certas patologias do fígado.
Pode atendê -lo: ácidos graxos essenciais: funções, importância, nomenclatura, exemplosAntioxidante
Embora nem todos os estudos relatados tenham sido realizados em pacientes humanos, mas geralmente esses são testes em modelos animais (geralmente murinos), os resultados obtidos em alguns ensaios clínicos afirmam a eficácia da glutationa exógena como antioxidante.
Por esse motivo, é usado para o tratamento de cataratas e glaucoma, como um produto de "antienvelhecimento", para o tratamento da hepatite, numerosas doenças cardíacas, perda de memória e fortalecimento do sistema imunológico e para a purificação após envenenando com metais pesados e drogas.
"Absorção"
Os glutathión administrados exogenamente não podem entrar nas células, a menos que sejam hidrolisados em seus aminoácidos constituintes. Portanto, o efeito direto da administração (oral ou intravenoso) deste composto é o aumento da concentração intracelular do GSH, graças à contribuição dos aminoácidos necessários para sua síntese, que pode ser efetivamente transportada para o citosol.
Efeitos secundários
Embora se considere que a ingestão de glutationa é "segura" ou inofensiva, não foram realizados estudos suficientes sobre seus efeitos colaterais.
No entanto, dos poucos estudos relatados, sabe -se que pode ter efeitos negativos que resultam da interação com outros medicamentos e que podem ser prejudiciais à saúde em vários contextos fisiológicos.
Se for tomado a longo prazo, parece que os níveis de zinco agem em diminuição excessiva.
Referências
- Allen, j., & Bradley, R. (2011). Efeitos da glutation oral. O Journal of Alternative and Complementary Medicine, 17(9), 827-833.
- Conklin, k. PARA. (2009). Antioxidantes alimentares durante a quimioterapia contra o câncer: impacto na eficácia quimioterapêutica e desenvolvimento de efeitos colaterais. Nutrição e câncer, 37(1), 1-18.
- Meister, a. (1988). Metabolismo da glutationa e sua modificação seletiva. O Journal of Biological Chemistry, 263(33), 17205-17208.
- Meister, a., & Anderson, M. E. (1983). Glutationa. Ann. Rev Biochem., 52, 711-760.
- Morris, d., Guerra, c., Khurasany, m., Guilford, f., & Saviola, B. (2013). Funções de macrófagos de melhoria da suplementação de glutationa no HIV. Revista de Pesquisa de Interferon e Citocinas, onze.
- Murray, r., Bender, d., Botham, k., Kennelly, p., Rodwell, v., & Weil, P. (2009). Bioquímica ilustrada de Harper (28ª ed.). McGraw-Hill Medical.
- Nelson, d. eu., & Cox, M. M. (2009). Lehninger Principles of Biochemistry. Edições Omega (5ª ed.). https: // doi.org/10.1007/S13398-014-0173-7.2
- Noctor, g., Mhamdi, a., Chaouch, s., Han, e. Yo., Neukermans, j., Marquez-Garcia, b.,... hall de entrada, c. H. (2012). Glutationa em plantas: uma visão geral integrada. Planta, células e meio ambiente, 35, 454-484.
- Pizzorno, J. (2014). Glutationa! Medicina Investigativa, 13(1), 8-12.
- Qanungo, s., Starke, d. C., Pai, h. V, myal, j. J., & Nieminen, para. (2007). Glutation. O Journal of Biological Chemistry, 282(25), 18427-18436.
- Ramires, p. R., & Ji, l. eu. (2001). A suplementação e o treinamento de glutationa aumentam a resistência do miocárdio à isquemia-reperfusão in vivo. Ann. J. Physiol. Coração circ. Physiol., 281, 679-688.
- Sies, h. (2000). Glutationa e seu papel nas funções celulares. Biologia e medicina de radicais livres r, 27(99), 916-921.
- Wu, g., Fang, e., Yang, s., Lupton, J. R., & Turner, n. D. (2004). Metabolismo da glutationa e suas implicações para a saúde. Sociedade Americana de Ciências Nutritais, 489-492.
- « Características de movimento retilíneo uniformemente acelerado, fórmulas, fórmulas
- Características, tipos, funções »

