Características da glicose oxidase, estrutura, funções
- 942
- 48
- Dennis Heidenreich
O Glicose oxidase, Também conhecido como β-d-glicose: oxigênio-1-oxidorraductase, glicose-1-oxidase ou simplesmente oxidase glicose, é uma enzima oxidoredutase encarregada da oxidação de β-d-glicose que produz d-gluconolactona e peróxido de hidrogênio.
Foi descoberto no final da década de 1920 em extratos de fungos Aspergillus niger. Sua presença foi comprovada em fungos e insetos, onde a produção permanente de peróxido de hidrogênio, por sua ação catalítica, tem funções importantes na defesa contra fungos patogênicos e bactérias.
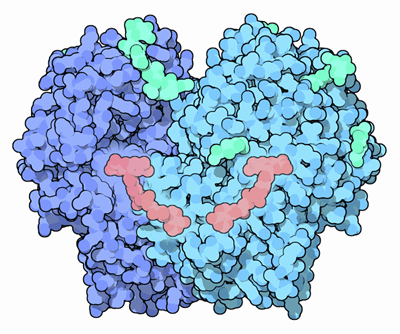
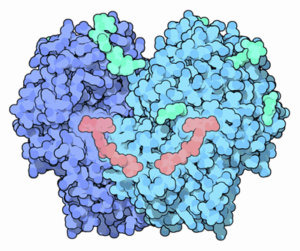 Esquema da estrutura da enzima de glicose oxidase (fonte Arcadiana, via Wikimedia Commons)
Esquema da estrutura da enzima de glicose oxidase (fonte Arcadiana, via Wikimedia Commons) Atualmente, a glicose oxidase foi purificada de muitas fontes de fungos diferentes, especialmente dos gêneros Aspergillus e Penicillium. Embora possa usar outros substratos, é bastante seletivo para a oxidação de β-d-glicose.
Tem vários lucros em contextos industriais e comerciais, o que se deve ao seu baixo custo de produção e grande estabilidade.
Nesse sentido, essa enzima é usada tanto na indústria de produção de alimentos quanto na cosmetologia, no diagnóstico farmacêutico e clínico, não apenas como aditivo, mas como biossensor e/ou reagente analítico de diferentes soluções e fluidos corporais.
[TOC]
Caracteristicas
A glicose a oxidase é uma flavoproteína globular que usa oxigênio molecular como aceitador de elétrons para produzir, de glicose, D-glycon-δ-lactona e peróxido de hidrogênio.
Em um sistema celular, o peróxido de hidrogênio produzido pode ser consumido pela enzima catlase para produzir oxigênio e água. Por sua vez, em alguns organismos, a d-gluconolactona é hidrolisada ao ácido glucônico, que pode exercer diferentes funções.
As enzimas de glicose oxidase descritas até agora são capazes de oxidar monossacarídeos e outros tipos de compostos, no entanto, e como comentados anteriormente, eles são bastante específicos para o anímer β-glicose.
Pode atendê -lo: esfrega de sangue: características, tipos, técnicas e histologiaEles trabalham em faixas ácidas, de 3.5 a 6.5 e, dependendo do microorganismo, esse intervalo pode variar consideravelmente. Além disso, a glicose fúngica é um dos três tipos de proteínas que são ligadas a ortofosfatos.
Como outros catalisadores biológicos, essas enzimas podem ser inibidas por diferentes moléculas, incluindo prata, cobre e mercúrio, hidrazina e hidroxilamina, fenil -hidrazina, bissulfato de sódio, entre outros, entre outros, entre outros, entre outros, entre outros, entre outros, entre outros, entre outros, entre outros, entre outros, entre outros.
Estrutura
A glicose a oxidase é uma proteína dimica com dois monômeros idênticos de 80 kDa cada, codificados pelo mesmo gene, unidos covalentemente unidos por duas pontes dissulfur e cujo dinamismo está envolvido no mecanismo catalítico da enzima.
Dependendo do corpo, o peso molecular médio do homodímero.
Estrutura de monômero
A análise dos monômeros de diferentes glicose oxidase encontrada na natureza revela que estes são divididos em duas regiões ou domínios diferentes: um que se liga ao moda e outro que se liga à glicose.
O domínio da Fad Union é composto de folhas banhadas por β, enquanto a junção de glicose masta.
Glicosilação
Os primeiros estudos realizados pela enzima de PARA. Níger Eles estabelecem que essa proteína possui 20% de seu peso fresco composto por aminoazúces e que outros 16-19% correspondem a carboidratos, dos quais mais de 80% são resíduos ligados à mão em proteínas por links por links por links N- ou QUALQUER-glicosídico.
Embora esses carboidratos não sejam essenciais para a catálise, há relatos que indicam que a eliminação ou remoção desse desperdício açucarado diminui a estabilidade estrutural da proteína. Isso pode ser devido à solubilidade e resistência contra proteases que essa camada de carboidratos dá.
Pode atendê -lo: animais vertebradosFunções
Nos fungos e insetos, como discutido, a glicose a oxidase cumpre uma função essencial da defesa contra fungos patogênicos e bactérias, mantendo uma fonte constante de estresse oxidativo pela produção permanente de peróxido de hidrogênio.
Falar sobre outras funções gerais da enzima glicose a oxidase não é tão simples, pois tem lucros muito particulares nos diferentes organismos que a expressam. Nas abelhas, por exemplo, sua secreção das glândulas hipofaríngeas para a saliva contribui para a preservação do mel.
Em outros insetos, dependendo do estádio do ciclo de vida, ele funciona na desinfecção dos alimentos ingeridos e na supressão de sistemas de defesa de plantas (quando se trata de insetos fitofágios, por exemplo).
Para muitos fungos, esta é uma enzima crucial para a formação de peróxido de hidrogênio que promove a degradação da lignina. Por sua vez, para outro tipo de fungos, é apenas um sistema de defesa antibacteriano e antifúngico.
Funções na indústria
No campo industrial, a glicose oxidase foi explorada de várias maneiras, entre as quais pode ser especificada:
- Como aditivo durante o processamento de alimentos, onde funciona como um antioxidante, conservante e estabilizador de produtos alimentícios.
- Na preservação de derivados de laticínios, onde ele trabalha como um agente antimicrobiano.
- É usado durante a produção de poeira de ovos para a eliminação da glicose e a produção de peróxido de hidrogênio que impede o crescimento de microorganismos.
- Ele também tem utilidade na produção de vinhos baixos em álcool. Isso se deve à sua capacidade de consumir a glicose presente nos sucos usados para fermentação.
Pode atendê -lo: lactoferrina: estrutura e funções- O ácido glucônico, um dos produtos secundários da reação catalisado pela glicose oxidase, também é explorado para manchas têxteis, limpando superfícies metálicas, como aditivo alimentar, como aditivo em detergentes e uniformes em medicamentos e cosméticos.
Sensores de glicose
Existem vários testes para censurar a concentração de glicose em diferentes condições que são baseadas na imobilização da enzima da glicose oxidase em um determinado apoio.
Três tipos de ensaios foram projetados no setor que usam essa enzima como biossensor e as diferenças entre eles são relativas ao sistema de detecção de consumo de glicose e/ou oxigênio ou a produção de peróxido de hidrogênio.
Além de sua utilidade na indústria de alimentos, os biossensores de glicose são explorados para a determinação da quantidade de glicose em fluidos corporais como sangue e urina. Geralmente são estudos de rotina para a detecção de condições patológicas e outras condições fisiológicas.
Referências
- Bankar, s. B., Bule, m. V, Singhal, R. S., & Ananthanarayan, L. (2009). Glicose oxidase - uma visão geral. Avanços de biotecnologia, 27(4), 489-501.
- Haouz, a., Torção, c., Zentz, c., Tauc, p., & Alpert, B. (1998). Propriedades dinâmicas e estruturais da enzima de glicose oxidase. EUR Biophys, 27, 19-25.
- Raba, J., & Mottola, H. PARA. (novecentos e noventa e cinco). Glicose oxidase como reagente analítico. Revisões críticas em química analítica, 25(1), 1-42.
- Wilson, r., & Turner, para. (1992). Glicose oxidase: uma enzima ideal. Biossensores e bioeletrônica, 7, 165-185.
- Wong, c. M., Wong, k. H., & Chen, x. D. (2008). Glicose oxidase: ocorrência natural, função, propriedades e aplicações industriais. Biotechnol Microbiol Appl, 75, 927-938.

