Estrutura, funções, classes e exemplos de glicoproteínas
- 3269
- 102
- Terrence King IV
As glicoproteínas qualquer Glucoproteínas São proteínas transket que fazem parte da grande família de glaconjugados da membrana e estão presentes em animais, plantas e microorganismos, como bactérias, leveduras e arcos.
Eles foram definidos pela primeira vez no ano de 1908 pelo Comitê de Nomenclatura de Proteínas da Sociedade Bioquímica Americana e são o resultado da união glicosídica de uma proteína com uma porção de carboidratos chamada glucano.
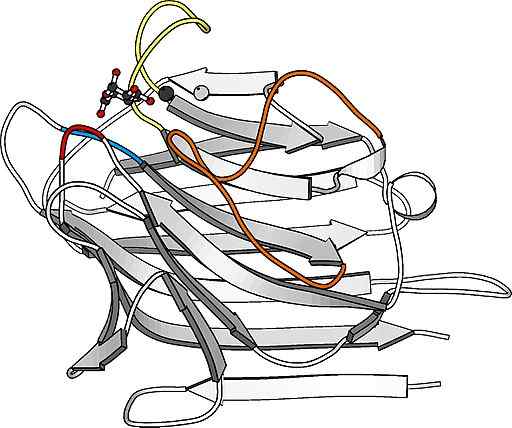
 Estrutura do monômero de lectina
Estrutura do monômero de lectina São proteínas particularmente abundantes na superfície da membrana plasmática de muitas células e constituem uma parte importante da camada de carboidratos que as cobre e que, em muitos casos.
As proteínas precursoras das glicoproteínas são modificadas covalentemente no retículo endoplasmático e no complexo de Golgi de muitos eucariotos após sua tradução, embora também haja casos de glicosilação no citosol, mas são menos comuns e ocorrem com um único tipo de açúcar.
A glicosilação da proteína geralmente tem efeitos funcionais importantes em sua atividade, pois pode participar do dobramento e, portanto, no estabelecimento de sua estrutura terciária.
Os glucanos têm múltiplas funções biologicamente importantes para a célula, pois podem conferir especificidade às células e participar de processos de sinalização intra e intercelular, pois são ligantes para receptores endógenos e exógenos.
As glicoproteínas, assim como o restante de Glyconjugados, são tão importantes que uma célula dedica até 1% de seu genoma a máquinas de glicosilação e, em humanos, mais de 70% das proteínas são modificadas por glicosilação.
[TOC]
Estrutura
A estrutura das glicoproteínas é estudada com base em sua sequência de aminoácidos, locais de glicosilação na sequência e nas estruturas de porções de glucano que são unidas nesses lugares.
As cadeias de oligossacarídeos que se ligam pela glicosilação a essas proteínas são geralmente muito diversas, mas são curtas, pois não excedem 15 desperdício de açúcar. Algumas proteínas têm uma única cadeia de oligossacarídeos, mas outros podem ter mais de um e estes podem ser ramificados.
A união entre oligossacarídeos e proteínas ocorre através do carbono anomérico de carboidratos e o grupo hidroxil (-OH) de um resíduo de serina ou treonina, no caso do QUALQUER-glicosilação, ou através do nitrogênio amida do resíduo de asparagina, no caso do N-glicosilação.
Os carboidratos unidos podem representar até 70% do peso molecular de uma glicoproteína e as características da porção de carboidratos (tamanho e carga, por exemplo) podem proteger algumas proteínas contra proteólise enzimática.
Pode atendê -lo: ágar de farinha de milho: fundação, preparação e usoA mesma proteína pode ter, em diferentes tecidos, diferentes padrões de glicosilação que a tornam uma glicoproteína diferente, uma vez que a estrutura completa inclui não apenas o desperdício de aminoácidos e seus arranjos espaciais, mas também para os oligossacarídeos ligados a estes.
Entre os resíduos de açúcar que estão repetidamente em glicoproteínas estão: D-galactose, D-Kinesea, D-Glucose, L-Fucose, D-Xilosa, L-Arabinofuranosa, N-acetil-D-glicosamina, N-acetil-D-galactosamina , alguns ácidos siálicos e modificações de todos esses.
Funções
Estrutural
Do ponto de vista estrutural, as glicoproteínas fornecem cadeias de carboidratos que participam da proteção e lubrificação das células, uma vez que elas são capazes de hidratar e formar uma substância viscosa que resiste a agressões mecânicas e químicas.
Nas bactérias e arcos, também existem algumas glicoproteínas e esses são componentes importantes da camada s, que é a camada mais externa da cobertura celular.
Além disso, eles também são encontrados como constituintes das proteínas da flagelina, que fazem parte dos filamentos flagelares que eles usam como órgãos locomotores.
As plantas também possuem glicoproteínas estruturais que são caracterizadas por padrões complexos de glicosilação e podem ser encontrados como parte da estrutura da parede celular ou na matriz extracelular.
Reconhecimento celular
Funções transcendentais de exercício de glicoproteínas, como locais de reconhecimento entre células, uma vez que muitos receptores de superfície celular são capazes de reconhecer seqüências específicas de oligossacarídeos.
Exemplo de reconhecimento intercelular que ocorrem através das cadeias de oligossacarídeos na superfície celular é o caso de reconhecimento entre o óvulo e o esperma, necessário para que o fenômeno da fertilização seja dado em organismos multicelulares com reprodução sexual com reprodução sexual.
O grupo sanguíneo em humanos é determinado pela identidade de açúcares ligados às glicoproteínas que as especificam. Anticorpos e muitos hormônios também são glicoproteínas e suas funções são essenciais para a sinalização e defesa corporais.
Adesão celular
As células T do sistema imunológico de mamíferos têm uma glicoproteína com domínios de adesão conhecidos como CD2, que é um componente -chave para estimulação imunológica desde a união entre o linfócito e o antígeno que apresenta células através de seu receptor, a glicoproteína CD58.
Alguns vírus que têm funções patogênicas importantes para muitos mamíferos, e entre eles seres humanos têm glicoproteínas de superfície que funcionam nos processos de adesão da partícula viral nas células que parasitam.
Pode atendê -lo: organismos autotróficosEsse é o caso da proteína GP120 do vírus humano da imunodeficiência adquirida ou HIV, que interage com uma proteína superficial de células humanas conhecidas como GP41 e colabora com a entrada do vírus da célula.
Da mesma maneira, muitas proteínas glicosiladas participam de importantes processos de adesão celular que ocorrem na vida comum das células presentes em muitos tecidos de organismos multicelulares.
Glicoproteínas como alvos terapêuticos
Esses complexos de proteína-carboidratos são os brancos preferidos por muitos patógenos, como parasitas e vírus, e muitas glicoproteínas com padrões aberrantes de glicosilação têm funções determinantes em doenças autoimunes e câncer.
Por esses motivos, vários pesquisadores deram a tarefa de elevar essas proteínas como possíveis alvos terapêuticos e para o design de métodos de diagnóstico, terapias de nova geração e até para o design da vacina.
Aulas
A classificação das glicoproteínas baseia -se principalmente na natureza do vínculo glicosídico que une porções de proteínas e carboidratos e nas características dos Unidos Glucanos.
De acordo com resíduos açucarados, as glicoproteínas podem ser obtidas com monossacarídeos, dissacarídeos, oligossacarídeos, polissacarídeos e derivados desses. Alguns autores consideram uma classificação de glicoproteínas em:
- Proteoglicanos, que são uma subclasse dentro do grupo de glicoproteínas que contém, na porção de carboidratos, os polissacarídeos compostos principalmente de aminoazúces (glucosaminoglicanos).
- Glicopeptídeos, que são moléculas compostas por carboidratos presos a oligopeptídeos formados por aminoácidos em suas conformações L e/ou D.
- Os aminoácidos gluco, que são aminoácidos ligados a um sacarídeo através de qualquer tipo de ligação covalente.
- Os aminoácidos glicosil, que são aminoácidos ligados a uma porção de sacarídeo através de ligações O, N- ou S-glicicosídicas.
Na nomenclatura dessas proteínas, assim unidos aos carboidratos são usados, os prefixos O-, N e S- para especificar através de quais links os açúcares são unidos à cadeia polipeptídica.
Exemplos
- A gliforina A é uma das glicoproteínas mais bem estudadas: é uma proteína integral da membrana eritrocitária (células ou glóbulos vermelhos do sangue) e possui 15 cadeias de oligossacarídeos ligados covalentemente ao desperdício de aminoácidos da região N-terminal através de de de de links QUALQUER-glicosídica e uma cadeia unida por um link N-glicosídico.
- A maioria das proteínas sanguíneas são glicoproteínas e esse grupo inclui imunoglobulinas e muitos hormônios.
Pode atendê -lo: importância do carbono nos seres vivos- A lactoalbumina, uma proteína presente no leite é a glicosilada, bem como muitas proteínas pancreáticas e liossômicas.
- Lectinas são proteínas da união de carboidratos e, para elas, elas têm várias funções em reconhecimento.
- Também é necessário destacar muitos hormônios animais que são glicoproteínas; Entre estes, pode mencionar lutropina (LH), folitropina (FSH) e tireotropina (TSH), que são sintetizados na glândula pituitária anterior, e gonadotropina coriônica que é produzida na placenta de humanos, primatas e cavalos.
Esses hormônios têm funções reprodutivas, uma vez que o LH estimula a esteroidogênese nos ovários e nas células testiculares de Leydig.
- Colágeno, a proteína abundante apresenta prioridade em tecidos conjuntivos de animais, representa uma enorme família de glicoproteínas compostas por mais de 15 tipos de proteínas que, embora tenham muitas características em comum, são bastante diferentes.
Essas proteínas contêm porções "não colagênicas", algumas das quais são formadas por carboidratos.
- Extensinas são proteínas vegetais que consistem em uma rede de glicoproteínas insolúveis que são ricas em resíduos de hidroxiprolina e serina. Eles são encontrados na parede das células vegetais e pensam que exercem funções em defesa contra diferentes tipos de estresse e patógenos.
- As plantas também têm proteínas de lectina e um exemplo especial destes são as lectinas de batata, que aparentemente têm a capacidade de reunir células sanguíneas como eritrócitos.
- Finalmente, mas não menos importante, pode ser nomeado mucinas, que são glicoproteínas secretadas em membranas mucosas e fazem parte da saliva em animais, cumprindo funções de lubrificação e sinalização, principalmente.
Referências
- Montreuil, J., Vliegenthart, J., & Schachter, H. (novecentos e noventa e cinco). Glicoproteínas. (PARA. Neuberger & l. Deenen, orgs.). Elsevier.
- Nelson, d. eu., & Cox, M. M. (2009). Lehninger Principles of Biochemistry. Edições Omega (5ª ed.). https: // doi.org/10.1007/S13398-014-0173-7.2
- Struwe, w., & Cosgrave, e. (2011). Proteômica funcional e estrutural de glicoproteínas. (R. Owens & J. Nettleship, eds.). Londres: Springer.
- Voet, d., & Voet, J. (2006). Bioquímica (3ª ed.). Editorial médico pan -American.
- Wittman, v. (2007). Glicopeptídeos e glicoproteínas. Síntese, estrutura e aplicação. (V. Balzani, J.-M. Lehn, a. De Meijere, S. Law, k. Houk, s. Schreiber, J. Thiem, orgs.). Leipzig: Springer Science + Business Media, LLC.
- « O atraso tecnológico e educacional na África e na América Latina
- Estrutura de ácidos graxos, tipos, funções, biossíntese »

