Galvanoplastia

- 2748
- 420
- Orlando MacGyver
Explicamos o que a galvanoplastia consiste, também chamada de eletrodeposição, como é seu processo, exemplos práticos e suas aplicações.
 Galvanoplastia de uma colher
Galvanoplastia de uma colher O que é galvanoplastia?
A galvanoplastia ou eletrodeposição é uma técnica eletroquímica que consiste, como o seu nome sugere, ao depositar camadas de metais em objetos recebidos; Isto é, cobrindo-os de uma tampa de metal, cuja espessura varia entre 5-20 μm.
Esta técnica também é conhecida como electroqueada ou banhado eletrolítico, como um meio eletrolítico composto por íons metálicos do metal desejado de depósito é indispensável para sua implementação. Portanto, se queremos um cobre banhado (cobre), precisaremos de sais solúveis de cobre, como sulfato de cobre, dissolvido em água.
O raciocínio anterior se aplica a qualquer outro metal: um eletrolítico de ouro requer sais de ouro, geralmente cianetos de ouro, que podem se tornar muito tóxicos. Assim, alguns objetos, como utensílios de alimentação, podem ser revestidos com ouro para atribuir maior valor e nobreza.
Mas a galvanoplastia vai além da estética: eles são conferidos. Também permite economizar recursos naturais, pois não é necessário gastar grandes quantidades de metal para revestimentos.
Processo de galvanoplastia
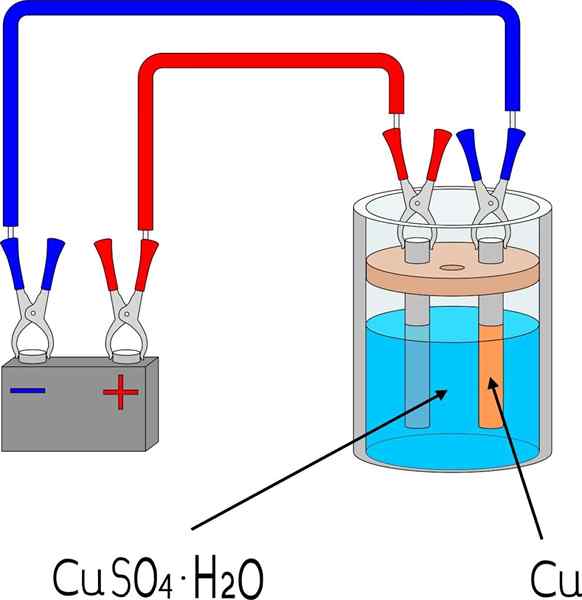 Eletrodeposição de cobre em um banheiro de sulfato de cobre
Eletrodeposição de cobre em um banheiro de sulfato de cobre Unid
Para eletrodeposição um metal em uma superfície, são necessários alguns elementos básicos, cujas dimensões e modo variam dependendo do lote de objetos a serem cobertos.
Na imagem superior, por exemplo, o eletrodo de cobre em pequena escala é mostrado, reproduzível em qualquer laboratório ou espaço.
Meio eletrolítico
Primeiro, é necessário um meio eletrólito do metal para eletrodeposito. Sal de sulfato de cobre, CuO4, É muito solúvel em água, por isso traz íons cu2+ que será então reduzido a átomos cu0. Esses átomos são aqueles que serão montados na superfície de recebimento para dar origem a cristais de metal.
O meio eletrolítico é indispensável para o circuito funcionar e as cargas iônicas podem se mover ou se mobilizar em direção à região onde ocorre a eletrodeposição.
Eletrodos
Os eletrodos são as superfícies nas quais a eletrodeposição ocorre de sua base química. Em termos simples, existem dois eletrodos: o cátodo, que é onde o metal é eletrodepos; E o ânodo, que é onde ocorre uma reação química que doa elétrons para os íons metálicos que cobrirão o cátodo.
Pode atendê -lo: uretano: estrutura, propriedades, obtenção, usosIsto é, o cátodo se torna a peça que é desejada. Enquanto isso, o ânodo é qualquer superfície na qual uma espécie oxida e doe seus elétrons para o cátodo. Muitas vezes o ânodo é feito do mesmo metal que é dissolvido no ambiente eletrolítico. Se houver cobre iônico no meio, neste caso o ânodo será de cobre metálico.
Circuito externo
O circuito externo é uma bateria que fornece os elétrons iniciais que promovem a eletrodeposição. Sua presença significa que a reação não é espontânea: a eletricidade é necessária para gerar uma mudança química, que é a redução de íons metálicos dissolvidos.
Limpeza do eletrodo
A peça a ser coberta deve estar completamente limpa. Caso contrário, o revestimento ou o revestimento estará com defeito.
Para fazer isso, você deve garantir que sua superfície seja totalmente hidrofílica, isto é, não tem gordura ou nenhuma sujeira. Uma maneira de garantir isso, após a lavagem química, é molhar a peça com água e, se a formação de gotas de água ou uma queda de líquido não uniforme for observada, significa que o eletrodo não está limpo ainda.
Reações e significado de elétrons
A galvanoplastia é uma reação redox. Portanto: uma espécie deve ser reduzida, enquanto a outra oxidada ou vice -versa. No cobre, temos um ânodo feito de cobre e um cátodo feito de metal (ferro, zinco, lata, etc.).
Quando ligamos a bateria, eles fluem elétrons para o cátodo, o que começa a carregar negativamente.
A carga negativa do cátodo atrai cátions2+ do ambiente eletrolítico, ocorrendo a redução:
Cu2+(AC) +2E- → Cu (s)
Pode servir você: reação de MaillardA bateria precisa recuperar os elétrons doados, e também os íons Cu devem ser recuperados2+ reduzido para manter a neutralidade do ambiente eletrolítico. É quando o ânodo vem em função: átomos de cobre oxidam:
Cu (s) → Cu2+(AC) +2E-
E os elétrons liberados são direcionados de volta à bateria, que por sua vez os mobiliza em direção ao cátodo para continuar a eletrodeposição.
O ânodo está ganhando carga positiva, o que atrai os íons SO42- do meio eletrolítico (veja a imagem mais uma vez).
Ou seja, as reações que ocorrem é a redução e oxidação do cobre, o metal que é eletrodepos:
Cu2+(AC) +2E- → Cu (s)
Cu (s) → Cu2+(AC) +2E-
O ânodo, de cobre, está perdendo massa enquanto o cátodo, de outro metal, é coberto com uma camada fina de cobre.
Exemplos de galvanoplastia
Prata
Os metais podem ser "eletroplatos", que os cobrem eletroliticamente de uma camada de prata. Isso é especialmente benéfico nos componentes eletrônicos que devem realizar eletricidade. A prata pode ser eletrodeposita em aço, cobre, níquel e outros metais.
Estanhado
O Tinner é a eletrodeposição de lata. É muito útil na produção de latas de ferro, que são cobertas com estanho para torná -las resistentes à corrosão e, portanto, não danificam os alimentos ou produtos que armazenam.
Latim ou bronzeado
Embora um pouco mais elaborado, bronze e bronze também podem ser eletrodepos em alguns metais para melhorar sua aparência.
Zincado
A galvanoplastia de zinco ou zinco (não confusa com galvanizada térmica) é usada principalmente para conceder resistência ao ferro à corrosão e superfícies mais brilhantes e atraentes. Assim, sua função é estética e ao mesmo tempo funcional, e é encontrada em partes do corpo, como as rodas.
Plásticos de metal
Os plásticos, previamente tratados com uma superfície condutora, também podem ser cobertos com metal, que é como se fossem seguidos a uma folha de papel alumínio.
Pode atendê -lo: frasco de kitasatoAplicações de galvanoplastia
Aplicações de galvanoplastia ou eletrodeposição podem ser divididas em funcional ou estética.
Funcional
 Um fino eletrodepos de ouro nos espectadores dos casos de astronautas permite que eles protejam seus olhos da luz do sol
Um fino eletrodepos de ouro nos espectadores dos casos de astronautas permite que eles protejam seus olhos da luz do sol O revestimento de uma peça ou objeto é fornecer à sua superfície propriedades que por si só carecem. Por exemplo, o eletrodPosition de cobre ou ouro faz as peças que eles têm, por isso é ideal nos circuitos eletrônicos aproveitar as propriedades desses metais, sem a necessidade de gastar toneladas de ouro na fabricação de peças inteiras e sólidas.
O ouro, por outro lado, protege as superfícies de calor e radiação. É por esse motivo que é amplamente utilizado nos satélites e nos capacetes dos astronautas, pois reflete a luz solar, preversando seus olhos, ou rapidamente quente.
Aços cromados ou malsados são muito resistentes à corrosão, graças precisamente a essas camadas de metal. É por isso que a galvanoplastia é usada na indústria para proteger metais sensíveis a corroir.
Estética
Os folheados metálicos brilham. Zinco, níquel e cromo são muito usados para esse fim. Além disso, ouro e prata são eletrodepos em anéis, correntes, pulseiras, gargantilhas, encostas, etc., E, portanto, sua galvanoplastia encontra muitas aplicações em joalherias e ornamentações, para aprimorar a imagem e o prestígio dessas roupas.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Wikipedia. (2021). Eletroplatação. Recuperado de: em.Wikipedia.org
- Chris Woodford. (28 de julho de 2020). Como funciona a eletroplatação. Recuperado de: ExplinthatStuff.com
- Rob Snyder. (s.F.). Eletrodeposição em nanoescala. Instituto de Educação STEM. [PDF]. Recuperado de: nanoescala.um L.Edu
- Elsevier b.V. (2021). Eletrodeposição. Cientedirect. Recuperado de: ScientEdirect.com
- Vaishali Mittal. (10 de dezembro de 2020). Eletroplatação. Química Librettexts. Recuperado de: química.Librettexts.org
- Singh Davneet. (9 de junho de 2020). Diferentes tipos de eletroplismo. Recuperado de: Teachoo.com
- Helmestine, Anne Marie, Ph.D. (26 de agosto de 2020). O que é eletroplacionamento e como funciona? Recuperado de: pensamento.com

