Van der Waals forças
- 3302
- 225
- Conrad Schmidt
Explicamos o que van der Waals são as forças, suas características, tipos e damos exemplos em cada
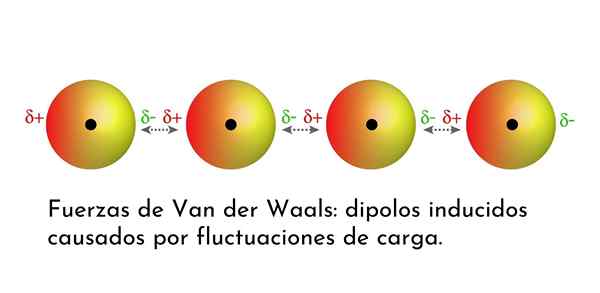
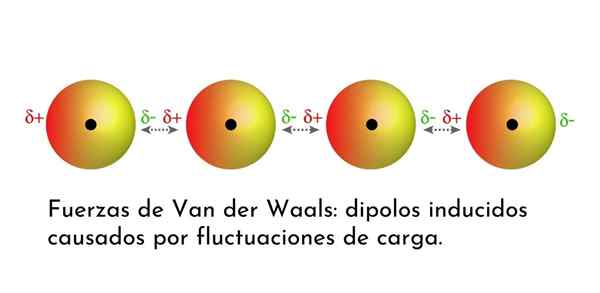 Ilustração que mostra um dos tipos de forças de van der Waals, as forças de dispersão de Londres, entre vários átomos com dipolo instantâneo
Ilustração que mostra um dos tipos de forças de van der Waals, as forças de dispersão de Londres, entre vários átomos com dipolo instantâneo Quais são as forças de van der Waals?
As Van der Waals forças Eles são um conjunto de forças de atração curta entre todos os átomos e moléculas. Eles recebem seu nome em homenagem ao cientista holandês Johannes Diderik van der Waals.
Essas forças são relativamente fracas, mas aparecem em toda a superfície de contato entre dois átomos, entre duas moléculas ou entre duas superfícies; portanto, se a superfície de contato é grande, as forças de van der Waals podem se tornar consideráveis.
O entendimento das forças de van der Waals permite prever qualitativamente muitas propriedades físicas de substâncias químicas, como seus pontos de fusão e ebulição e solubilidade em diferentes tipos de solventes. Essas são as forças que permitem explicar como é possível que um gás monoatômico, como o hélio, que não forma nenhum tipo de ligação química, possa se condensar e se mover para o estado líquido.
Essas forças também explicam por que uma substância como a água, formada por moléculas cuja massa molar é apenas 18 g/mol, é líquida, enquanto o cloro, que pesa quase 4 vezes mais, é um gás à temperatura ambiente.
Características das forças de van der Waals
Além de representar um tipo de força de atração entre átomos e moléculas, as forças de van der Waals não compartilham muitas características com ligações químicas. Em seguida, são apresentadas as características mais destacadas desse tipo de forças:
- Eles são forças dependentes da distância. No caso mais simples, eles diminuem com o quadrado da distância. Além disso, eles dependem fortemente da geometria molecular.
- Comparado às forças de atração que ocorrem nos vínculos iônicos, covalentes e metálicos, as forças de van der Waals são relativamente fracas.
- Com exceção das interações dipolo-dipolo, são interações de temperatura independentes.
- São forças de curta duração, o que significa que elas diminuem rapidamente à medida que átomos e moléculas se afastam.
- São forças gerais que ocorrem entre qualquer átomo e qualquer molécula.
- Ao contrário de ligações covalentes, elas não têm direcionalidade. Isso significa que, independentemente da orientação com a qual duas moléculas se aproximam, se elas se aproximarem o suficiente, as forças de van der Waals sempre aparecerão.
- Quando duas moléculas ou átomos se aproximam demais, a força se torna repulsiva, o que impede que as moléculas se colapsem.
- Eles são aditivos, o que significa que, apesar de serem consideravelmente fracos, a existência de muitas interações simultâneas pode fazer com que a força total de atração seja considerável.
Tipos de forças de van der Waals
Além do componente repulsivo que garante que átomos e moléculas não entrem em colapso, existem três tipos de forças de van der Waals, que podem ou não agir ao mesmo tempo entre duas moléculas ou átomos. Estes são apresentados abaixo:
1. Interações dipolo-dipolo ou forças de keesom
A força de Keesom é um dos contribuintes para a força de van der Waals. Essas são as forças de interação eletrostática que aparecem entre os dipolos permanentes das moléculas polares, como água, acetona e outros.
As forças de Keesom são semelhantes às forças eletrostáticas entre íons, mas diferem delas, pois são muito mais fracas e decair com o sexto poder de distância (ou seja, com r6). A razão pela qual eles são mais fracos é que a atração ocorre entre as cargas parciais de um dipolo, em vez de cargas elétricas inteiras, como no caso de íons.
Essas interações são dadas apenas entre moléculas e não entre átomos, pois os átomos não têm momentos de dipolo permanentes. Além disso, a força de Keesom é inversamente proporcional à temperatura, o que significa que, quando aumenta, a força de Keesom diminui.
Exemplos de moléculas que têm interações dipolo-dipolo
Todas as moléculas polares têm interações dipolo-dipolar. Por exemplo:
- Duas moléculas de acetona.
- Duas moléculas de clorofórmio.
- Uma molécula de ciclohexanona com uma molécula de acetona.
2. Interações dipolo-dipolo induzidas ou forças de Debye
Quando uma molécula polar se aproxima de um átomo ou uma molécula apolar, o dipolo do primeiro atrai ou repete elétrons na superfície do segundo. Isso induz um dipolo na molécula apolar, que é chamada de dipolo induzido. O novo dipolo formado e interage com o dipolo original, criando uma pequena força de atração.
Pode atendê -lo: calor de combustãoEssas interações entre um dipolo permanente e induzido são geralmente conhecidas como forças de Debye e dependem não apenas da distância entre as duas moléculas ou entre a molécula polar e um átomo individual, mas também dependem da polarizabilidade da molécula apolar e da magnitude do momento dipolar da molécula polar.
Exemplos de moléculas que induziram interações dipolo-dipolo
Esse tipo de interação é dado apenas entre diferentes moléculas, pois um é necessário para ser polar e que o outro não. Alguns exemplos são:
- Um átomo de um gás nobre como o argônio e um composto polar, como cloreto de hidrogênio. Nesse caso, a carga parcial positiva no hidrogênio HCL atrai os elétrons de Valência do argônio, gerando um pequeno dipol induzido neste último. Se um argônio se aproximar do átomo de cloro, a carga parcial negativa repelirá os elétrons de valência e um dipolo induzido também será formado.
- O brominato molecular (BR2) É consideravelmente solúvel em água, apesar de ser um composto apolar e a água de um solvente fortemente polar. A explicação é devida, em parte, à alta polarizabilidade do bromo que permite formar interações consideravelmente fortes.
3. Interações induzidas por dipolo-dipolo induzidas ou forças de dispersão de Londres
De todas as forças de van der Waals, as mais fracas são as forças de dispersão de Londres. Essas interações são dadas entre todos os átomos e moléculas devido ao aparecimento de dipolos instantâneos em qualquer parte de sua estrutura.
Um dipolo instantâneo é um pequeno dipolo formado por uma distribuição assimétrica de elétrons de valência em um determinado momento.
Pode atendê -lo: hidrocarbonetos insaturadosComo os dipolos instantâneos são gerados?
À medida que os elétrons giram em torno do núcleo, pode acontecer que, ao mesmo tempo, haja mais elétrons de um lado do que do outro, o que dá origem a um dipolo. Este pequeno dipolo desaparece rapidamente à medida que os elétrons continuam se movendo ao redor do núcleo, e é por isso que eles são chamados de instantâneos.
Dipóis instantâneos podem surgir em qualquer lugar da estrutura de uma molécula e, a qualquer momento, pode haver muitos deles. As forças de dispersão de Londres consistem na interação entre esses tempos instantâneos em uma molécula e aqueles de outro.
Exemplos de compostos que têm forças de dispersão em Londres
Como mencionado, esses tipos de interações ocorrem entre todos os átomos e moléculas. No entanto, é nas grandes moléculas apolares onde seu efeito pode ser melhor observado, pois nesses casos é o único tipo de interação intermolecular que ocorre.
Um exemplo típico em que essas forças são muito intensas é no caso de hidrocarbonetos alifáticos de cadeia longa, especialmente em polímeros como o polietileno.

