Força iônica das unidades, como calculá -la, exemplos

- 1775
- 340
- Conrad Schmidt
O força iônica É uma maneira de expressar a concentração de íons em uma solução. Este conceito foi introduzido em 1922 por Lewis e Randall enquanto trabalhava na descrição do coeficiente de atividade química.
Quando a concentração dos íons em uma solução é alta, é produzida uma interação eletrostática entre os íons opostos; Ou seja, cátions e ânions são muito atraídos, o que resulta em concentração iônica eficaz ou real é menor que a calculada para uma reação química específica.
 A força iônica da água do mar é alta, cerca de 0.7, devido à sua grande concentração de sais dissolvidos
A força iônica da água do mar é alta, cerca de 0.7, devido à sua grande concentração de sais dissolvidos Por esse motivo, o conceito de atividade química foi introduzido como a concentração iônica eficaz de uma solução, sendo a atividade química o produto da molaridade da solução pelo coeficiente de atividade química.
Este coeficiente tem um valor próximo à unidade (1) para soluções iônicas diluídas e para as soluções ideais chamadas SO -. São soluções em que a interação intermolecular entre moléculas semelhantes é igual à existente entre diferentes moléculas.
A criação do conceito de força iônica contribuiu para a explicação dos desvios do comportamento ideal, observado em soluções iônicas reais.
[TOC]
Unidades de força iônica
A força iônica tem como unidades moles/L (molaridade) ou moles/kg de água (molalalidade). Este último é recomendado em soluções não ideais, que são caracterizadas porque os volumes de suas misturas não são totalmente aditivos.
Isso significa, por exemplo, o seguinte: se misto 0.5 litros de um líquido A e 0.5 litros de um líquido B, o volume resultante desta mistura, não serão necessariamente iguais a 1 litro, mas podem ser diferentes.
A força iônica é representada pelo símbolo i.
Pode atendê -lo: butanal: estrutura, propriedades, usos e riscosComo calcular a força iônica?
Para o cálculo da força iônica de uma solução, a concentração de todos os íons presentes na solução são levados em consideração, bem como suas respectivas valências.
O valor da força iônica é obtido aplicando a seguinte fórmula:
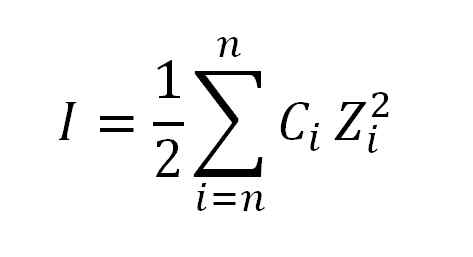 Fórmula usada para calcular a força iônica. Fonte: Gabriel Bolívar.
Fórmula usada para calcular a força iônica. Fonte: Gabriel Bolívar. Onde eu, como já disse, é a força iônica; C, corresponde à concentração de íons iônicos ou morais moral; Enquanto z, representa suas respectivas valências (± 1, ± 2, ± 3, etc.).
La expresión que aparece en la fórmula en el cálculo de la fuerza iónica (Σ) se lee como sumatoria, es decir, la suma del producto de la concentración molar (C) de cada ión presente en la solución por su valencia (Z) elevada ao quadrado.
Como pode ser visto, a valência do íon tem o maior peso no valor da força iônica da solução. Por exemplo: Valência (z) de CA é +2, então z2 É o mesmo 4. Enquanto isso, Valência (z) de Na Es +1 e, portanto, Z2 É o mesmo 1.
Isso ressalta que a contribuição do íon ca2+ Para o valor da força iônica, para a mesma concentração iônica molar, é quatro vezes maior que a do íon na ná+.
Importância da força iônica
A força iônica é uma medida adequada da concentração iônica de uma solução e é a base para estabelecer a teoria de Debye-Hückel. Esta teoria descreve o comportamento ideal das soluções iônicas.
A força iônica serve como base para o cálculo do coeficiente de atividade (γYo), parâmetro que por sua vez permite o cálculo da atividade química de um composto iônico, sendo a atividade química a concentração eficaz e real de um composto iônico na solução.
Pode servir a você: acetato de alumínio (AL (CH3COO) 3): estrutura, propriedades, usosAo aumentar a força iônica de uma solução, a interação entre os íons aumenta. Portanto, diminuir γYo e a atividade química dos íons.
Um aumento na força iônica pode diminuir a solubilidade das proteínas em um ambiente aquoso, sendo essa propriedade usada para a precipitação de proteínas seletivamente. Soluções de sulfato de força iônica de alta força são usadas para precipitação e purificação de proteínas plasmáticas.
Exemplos de forças iônicas
Exemplo 1
Calcule a força iônica de uma solução de cloreto de potássio (KCl) 0.3 m.
KCl se dissocia da seguinte maneira:
Kcl → k+ + Cl-
Temos dois íons: o k cation+ (Z =+1) e o clo anion- (Z = -1). Em seguida, aplicamos a fórmula para calcular a força iônica I:
I = 1/2 [c · (+1)1 + C · (-1)1]
= 1/2 [0.3 m · 11 + 0.3 m · 11]
= 0.3 m
Observe que a valência -1 do CL- Foi tomado como 1, seu valor absoluto, uma vez que a força iônica seria igual a 0.
Exemplo 2
Calcule a força iônica de uma solução de sulfato de cálcio (caso4) 0.5m
O caso4 Ele se dissocia da seguinte maneira:
Caso4 → Ca2+ + SW42-
Temos dois íons: o Cation2+ (Z =+2) e o ânion SO42- (Z = -2). Em seguida, aplicamos a fórmula para calcular a força iônica I:
I = 1/2 [c · (+2)2 + C · (-2)2]
= 1/2 [0,5 m · 4 +0,5 m · 4]
= 2 m
Exemplo 3
Calcule a força iônica de um amortecedor com as concentrações finais de fosfato de sódio dibásico (Na2HPO4) 0.3 me fosfato de sódio monobásico (NAH2Po4) 0.4 m.
Então uma2HPO4 Ele se dissocia da seguinte maneira:
Pode atendê -lo: ácido arsênico (H3SO4): propriedades, riscos e usosN / D2HPO4 → 2º+ + HPO42-
Enquanto o NAH2Po4 Ele se dissocia seguindo o seguinte padrão:
Nah2Po4 → Na+ + H2Po4-
Procedemos como os exercícios anteriores, desta vez tendo os ânions HPO42- (Z = -2) e h2Po4- (Z = -1):
I = 1/2 [c · 2 · (+1)1 + C · (-2)2] +[C · (+1)1 + C · (-1)1]
= 1/2 [0.3 m · 2 · 1 +0.3 m · 4] +[0.4 m · 1 +0.4 m · 1]
= 1/2 [0.6 m +1.2 m] +[0.4 m +0.4 m]
= 1.3 m
Observe que a concentração de Na+ do Na2HPO4 É multiplicado por 2, pois sua concentração é dupla. No entanto, para o outro sal, não2Po4, A concentração de Na+ Sim, nós multiplicamos por 1, de acordo com a estequiometria de sua equação de dissolução.
Exemplo 4
Calcule a força iônica de uma solução de cloreto de sódio (NaCl) 0.15 me glicose (C6H12QUALQUER6) 0.3 m.
A NaCl se dissocia da seguinte maneira:
NaCl → Na+ + Cl-
A glicose, no entanto, não é dissociada em íons porque possui apenas ligações do tipo covalente em sua estrutura química. Portanto, a Valencia de la glucosa (z) é igual a zero (0). Em seguida, calculamos o produto da força iônica da NACL:
I = 1/2 [c · (+1)1 + C · (-1)1]
= 1/2 [0.15 m · 1 +0.15 m · 1]
= 0.15 m
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Wikipedia. (2020). Força de íons. Recuperado de: em.Wikipedia.Ou
- Dr. David k. Ryan. (s.F.). Atividade e força iônica Classe 4 Ryan. [PDF]. Recuperado de: facty.uml.Edu
- Universidade de Michigan. (s.F.). Uma visão mais detalhada do equilíbrio químico. [PDF]. Recuperado de: Umich.Edu
- Elsevier b.V. (2020). Força de íons. Cientedirect. Recuperado de: ScientEdirect.com
- C.D. Kennedy. (1990). Stenth Itngth e Dinsociation of Acids. [PDF]. Recuperado de: iubmb.Biblioteca online.Wiley.com
- « Textos literários Características, tipos e exemplos
- Estrutura de Isopreno, propriedades, aplicações »

