Estrutura de fosfato de sódio, propriedades, síntese, usa

- 1219
- 70
- Orlando MacGyver
Ele Fosfato de sódio É um sal inorgânico cuja fórmula química é na na3Po4. Ele também recebe nomes de fosfato trisodioso (TSP para seu acrônimo em inglês: Fosfato trissódico), ou fosfato de sódio tribásico, porque não tem a capacidade de doar íons de hidrogênio H+.
Ao aludir a ele de uma maneira plural, fosfatos de sódio, se fala de todo o compêndio de sais, hidratado ou não, originado de interações eletrostáticas entre Na+ e o PO43-. Alguns desses sais consistem em pirofosfatos de sódio, ou polímeros inorgânicos que possuem o PO43- como monômero.
 Vidro do relógio com cristais de fosfato de sódio. Fonte: Ondřej Mangl [Domínio Público]
Vidro do relógio com cristais de fosfato de sódio. Fonte: Ondřej Mangl [Domínio Público] É por isso que, a menos que uma especificação seja feita, ela sempre se referirá a NA3Po4, E não para não2PO4, NA2HPO4, N / D4P2QUALQUER7 Não qualquer outro sal.
A imagem superior mostra a aparência de fosfato de sódio, que parece cristais brancos semelhantes aos de sal ou mesa comum, ou comprado como um pó de aparência amorfa branca. Então uma3Po4 é capaz de formar vários hidratos, sendo o NA3Po4· 12h2Ou aquele que é mais comercializado.
Ele encontra uso principalmente na indústria de alimentos, em detergentes, suplementos esportivos e serve como laxante hiperosmótico.
[TOC]
Estrutura química
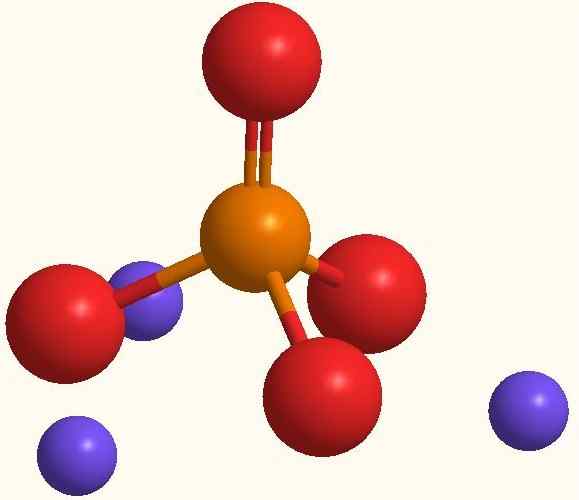 Principais íons de fosfato de sódio. Fonte: Smolamj via Wikipedia.
Principais íons de fosfato de sódio. Fonte: Smolamj via Wikipedia. A mesma fórmula de NA3Po4 indica que para cada ânion PO43- Existem três cátions de na+. Esses íons podem ser observados na imagem superior. Observe que o PO43- Possui geometria tetraédrica, com seus átomos de oxigênio carregando uma carga negativa ressonante, o que atrai o Na+ do ambiente.
Além disso, a fórmula NA3Po4 Ele ressalta que é um sal anidro, então não há moléculas de água incluídas em seus cristais. Atrações eletrostáticas entre Na+ e o PO43- Eles acabam definindo um cristal branco trigonal. Seu link iônico é tal que o NA3Po4 Tem um ponto de fusão de 1583 ºC, consideravelmente maior que o de vários sais.
Pode servir a você: Reação Cannizzaro: características, mecanismos, exemplosAmbos o Na+ Como Po43- São íons que podem ser hidratados em alto grau, sem afetar negativamente a estabilidade dos cristais.
É por esse motivo que os hidratos também podem cristalizar; No entanto, seus pontos de fusão são inferiores aos do sal anidro, pois as pontes intermoleculares de hidrogênio da água separam os íons e enfraquecem suas interações. No Na3Po4· 12h2Ou, por exemplo, seu ponto de fusão é 73,4 ºC, muito menor que o de Na3Po4.
Propriedades
Aparência física
Pode ocorrer como cristais brancos definidos ou como poeira ou grânulos da mesma cor. Todas as magnitudes físicas expressas abaixo aludem apenas ao sal ingênuo3Po4.
Ponto de fusão
1583 ºC
Ponto de ebulição
100 ºC
Solubilidade em água
14,5 g/100 ml a 25 ° C, por isso é considerado um fosfato de água bastante solúvel. No entanto, é insolúvel em solventes orgânicos, como etanol e dissulfeto de carbono.
Densidade
2.536 g/cm3 a 17,5 ºC.
Estabilidade
É um sólido higroscópico. Portanto, deve ser armazenado de tal maneira que não possa ser exposto à umidade.
ph
É um sal fortemente alcalino. Por exemplo, uma solução aquosa de 0,1% já possui pH 11,5. Esta propriedade serve para ser usada como um aditivo em detergentes.
Síntese
Como o fosfato de sódio é produzido ou sintetizado? Para fazer isso, é baseado em ácido fosfórico, h3Po4, ou de sal do sal de sal, sódio, nah2Po4.
Na grande maioria da síntese, H é preferido3Po4. Assim, o H é reagido3Po4 Com uma base que neutraliza seus três grupos de OH, levando em consideração que esse ácido também pode ser escrito como PO (OH)3.
Pode atendê -lo: Balanço de Assunto: O que é, equação geral, tiposA base por preferência é o hidróxido de sódio, NaOH (na Alemanha), mas também é viável (e mais barato) usar carbonato de sódio ou cinza de Sosa, na2Co3 (nos Estados Unidos). As equações para ambas as reações de neutralização são:
N / D2Co3 + H3Po4 → Na2HPO4 + Co2 + H2QUALQUER
N / D2HPO4 + NaOH → Na3Po4 + H2QUALQUER
Observe que ao usar o NA2Co3 NA não é obtido3Po4 mas o na2HPO4, que precisará de neutralização subsequente. Ser a reação aquosa significa, cristaliza o NA3Po4· 12h2Ou, portanto, deve ser calculado para eliminar seu teor de água e causar sal anidro.
Então uma3Po4· 12h2O é caracterizado por "mesclar" seus cristais em uma massa compacta difícil. Quanto menor o tamanho de seus cristais, mais rápido será sua calcinação.
Formulários
Comida
 O fosfato de sódio é usado como um agente efervescente para expandir papéis ou bolos de canela ou bolos. Fonte: Pixabay.
O fosfato de sódio é usado como um agente efervescente para expandir papéis ou bolos de canela ou bolos. Fonte: Pixabay. No fosfato de sódio, é inevitável misturar o NA3Po4 ou na3Po4· 12h2Ou, porque o último é o hidrato que é mais comercializado. Por exemplo, qualquer um dos dois fornece íons inofensivos (em teoria) aos alimentos aos quais são adicionados, enriquecendo -os de fosfatos e, ao mesmo tempo, aumentam sua salinidade.
No salar das carnes, o NA3Po4· 12h2Ou está incluído para mantê -los frescos por mais tempo durante o armazenamento. Também é adicionado como um agente emulsificante para que a mistura de óleo de água não seja "cortada", mas permaneça unida; E como um regulador de pH, porque ajuda a reduzir a acidez dos alimentos (incluindo cereais).
Pode atendê -lo: silicato de cálcio: propriedades, estrutura, obtenção, usaAlém disso, é usado para engrossar alguns molhos de tomate e para assar bolo ou pão (imagem superior). O último é porque o NA3Po4· 12h2Ou tende a liberar vapor de água, o que aumenta o tamanho dos poros da massa de farinha e o volume do mesmo.
Detergentes
O fosfato de sódio é básico o suficiente para saponificar algumas gorduras ou óleos com os quais você tem contato. Sua alcalinidade é então usada para melhorar a ação dos detergentes, desde que a superfície da miséria não seja metal, pois eles podem deteriorá -la.
No entanto, a produção de detergentes enriquecidos com fosfatos foi reduzida porque produzem a eutrofização de lagos e rios e, com ele, a proliferação de algas que cobre suas superfícies.
Também tem sido usado para a elaboração de um desinfetante: na3Po4· 1/4naocl · 11h2Ou, que é preparado usando hipoclorito de sódio, NaOCl, em vez de NaOH ou Na2Co3 Para neutralizar h3Po4.
Medicinal
Então uma3Po4 Induz a defecação agindo como um laxante hiperosmótico, necessário para limpar o cólon antes que o paciente sofra uma colonoscopia. Por outro lado, também foi usado (adicionado) em suplementos de energia.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Centro Nacional de Informações sobre Biotecnologia. (2019). Fosfato trissódico. Banco de dados PubChem. CID = 24243. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Wikipedia. (2019). Fosfato trissódico. Recuperado de: em.Wikipedia.org
- Curran m.P. & Plosker g.eu. (2004). Solução de fosfato de sódio oral: uma revisão de seus usos para limpador colorretal. Doi: 10.2165/00003495-200464150-00009
- Corey Whelan. (22 de dezembro de 2017). Fosfato de sódio. Recuperado de: Healthline.com
- Jacobs, Joel B. Taborosi, Steve. (2019). Processo para a produção de fosfato de trisódio. Recuperado de: Freepatentssonline.com
- Maryann Marks. (2018). Por que o fosfato de trissódio (TSP) é adicionado à nossa comida? Recuperado de: theingredientguru.com

