Estrutura de fosfato de alumínio (alpo4), propriedades, obtenção, uso

- 5200
- 276
- Ralph Kohler
Ele Fosfato de alumínio É um sólido inorgânico formado por um íon de alumínio para o3+ e um ion fosfato PO43-. Sua fórmula química é alpo4. É um sólido branco cuja estrutura cristalina é semelhante à de sílica sio2. É insolúvel em água.
Pode ser obtido de alumina (para2QUALQUER3) e ácido fosfórico (H3Po4). Também pode ser obtido com base em soluções aquosas de cloreto de alumínio (ALCL3) e fosfato de sódio (NA3Po4).
 Fosfato de alumínio alpo4. Ondřej Mangl [Domínio Público]. Fonte: Wikimedia Commons.
Fosfato de alumínio alpo4. Ondřej Mangl [Domínio Público]. Fonte: Wikimedia Commons. O fosfato de alumínio tem um ponto de fusão muito alto, por isso é amplamente utilizado como um componente de cerâmica refratária, ou seja, cerâmica que suporta temperaturas muito altas.
Também é usado como um antiácido para o estômago, em misturas para o reparo dos dentes e como um adjuvante de vacinas, isto é, para estimular a resposta imune do organismo.
Algum concreto refratário tem alpo4 Em sua composição, o que aumenta as propriedades mecânicas e de suporte de altas temperaturas desse tipo de cimento.
Foi usado como um escudo de proteção para evitar materiais combustíveis como certos polímeros.
[TOC]
Estrutura
O alpo4 É formado por um cátion de alumínio para o3+ e um ânion fosfato PO43-.
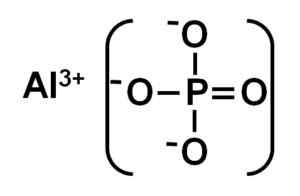 Estrutura iônica de fosfato de alumínio. Autor: Marilú Stea.
Estrutura iônica de fosfato de alumínio. Autor: Marilú Stea. O fosfato de alumínio cristalino também é chamado de fase de berlinita ou alfa (α-alpo4) e seus cristais são semelhantes ao quartzo.
 Cristais sintéticos de berlinita (α-alpo4). DmGualtieri [CC BY-SA (https: // criativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons.
Cristais sintéticos de berlinita (α-alpo4). DmGualtieri [CC BY-SA (https: // criativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons. A fase alfa do fosfato de alumínio é um sólido formado por uma rede covalente de PO tetraedra4 e alpo4 que alternam e são unidos por átomos de oxigênio.
Essa estrutura é isomórfica com sílica, ou seja, tem a mesma forma que a do SIO2.
Nomenclatura
- Fosfato de alumínio
- Monofosfato de alumínio
- Sal de alumínio de ácido fosfórico.
Propriedades
Estado físico
Sólido branco cristalino.
Peso molecular
121,93 g/mol
Ponto de fusão
1800 ºC
Densidade
2,56 g/cm3
Solubilidade
Insolúvel em água
Outras propriedades
A estrutura alpo4 É muito semelhante ao da sílica Sio2, por isso compartilha muitas propriedades físicas e químicas deste.
Pode atendê -lo: água desionizadaO fosfato de alumínio é um material altamente refratário, ou seja, resiste a temperaturas muito altas sem alterar sua condição física ou sua estrutura e sem decompor.
O alpo4 Cristalino ou Berlinita Quando é aquecido, torna -se uma estrutura do tipo Thundimita e depois o tipo Christobalite, outras formas deste composto que se assemelham à sílica sio2.
 Fosfato de alumínio. Chemicalintest [domínio público]. Fonte: Wikimedia Commons.
Fosfato de alumínio. Chemicalintest [domínio público]. Fonte: Wikimedia Commons. Obtenção
Fosfato de alumínio alpo4 Pode ser obtido por reação entre ácido fosfórico H3Po4 e alumina al2QUALQUER3. A aplicação de temperatura é necessária, por exemplo, entre 100 e 150 ° C.
Para o2QUALQUER3 + 2 h3Po4 = 2 alpo4 + 3 h2QUALQUER
Também pode ser obtido juntando -se a uma solução aquosa de cloreto de alumínio ALCL3 com uma solução aquosa de fosfato de sódio na3Po4:
Alcl3 + N / D3Po4 = Alpo4 + 3 NACL
Use em cerâmica
Fosfato de alumínio alpo4 É frequentemente encontrado na constituição da cerâmica de alumina.
Cerâmica com alto teor de alumina é um dos materiais usados em aplicações nas quais é necessário para resistir a cargas altas e condições graves.
Esse tipo de cerâmica é resistente à corrosão, a ambientes de alta temperatura, à presença de vapor quente ou na redução de atmosferas como o monóxido de carbono (CO).
A cerâmica de alumina também possui baixa condutividade elétrica e térmica, por isso é usada para fazer tijolos refratários e componentes isolantes de eletricidade.
 Revestimento de tijolo refratário que pode conter fosfato de alumínio alpoo4. Esses tijolos protegem de altas temperaturas. Alexknight12 [CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons.
Revestimento de tijolo refratário que pode conter fosfato de alumínio alpoo4. Esses tijolos protegem de altas temperaturas. Alexknight12 [CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons. Porque o fosfato de alumínio é formado a uma temperatura muito mais baixa que a sílica sio2, Sua produção é mais barata, que constitui uma vantagem na fabricação de cerâmica apropriada para exigir serviços.
Fabricação de cerâmica de fosfato de alumínio
Alumina está acostumada a2QUALQUER3 e ácido fosfórico H3Po4 Em meio aquoso.
A formação preferida pH é 2-8, pois há abundância de espécies de ácidos fosfóricos dissolvidos, como H2Po4- e HPO42-. Uma concentração de íons ácidos em3+ É alto, desde a dissolução da alumina até o2QUALQUER3.
Pode atendê -lo: tetracloreto de carbono (CCL4)Em primeiro lugar, um gel de tri -hidrogênio de alumínio -hidratado de Alhidrado3(Po4)2.H2QUALQUER:
Para o3+ + H2Po4- + HPO42- + H2Ou ⇔ ALH3(Po4)3.H2QUALQUER
No entanto, chega um momento em que o pH da baixa solução e se torna neutro, onde alumina para o2QUALQUER3 apresenta uma baixa solubilidade. Neste momento, a alumina insolúvel forma uma camada na superfície das partículas que impedem a reação de continuar.
Portanto, é necessário aumentar a solubilidade da alumina e isso é alcançado suavemente. Aquecimento a 150 ° C, o gel continua a reação com alumina ao2QUALQUER3 liberando água e forma a Berlinita cristalina (alfa-alpo4).
Para o2QUALQUER3 + 2 Alh3(Po4)3.H2O → alpo4 + 4 h2QUALQUER
Berlinita se junta a partículas e cerâmicas individuais são formadas.
Outros usos
O alpo4 É usado como um antiácido, como um adsorvente, como uma peneira molecular, como suporte de catalisador e como um revestimento para melhorar a resistência à corrosão a quente. Aqui estão outras aplicações.
Na obtenção de concreto
O fosfato de alumínio é um ingrediente de refratário ou concreto resistente ao calor.
Fornece excelentes propriedades mecânicas e refratantes a esses concretos, como resistência ao calor. No intervalo de temperatura entre 1400-1600 ° C, o concreto celular baseado no fosfato de alumínio é um dos materiais mais eficientes, como o isolador térmico.
Não requer secagem, seu endurecimento é alcançado por uma reação exotérmica autopropagada. É possível preparar tijolos deste material de qualquer forma e tamanho.
Em cimentos dentários
O fosfato de alumínio faz parte de cimentos dentários ou materiais que são usados para curar a prótese carregada.
Em cimentos dentários, a alumina é usada como um moderador de reações ácidas-base, onde o efeito moderador é devido à formação de fosfato de alumínio nas partículas de outros materiais.
Esses cimentos têm compressão muito alta e resistência à tensão, que se deve à presença de fosfato de alumínio.
 Cimentos dentários usados para curar a cárie podem conter fosfato de alumínio. Autor: Gerber Challenge. Fonte: Pixabay.
Cimentos dentários usados para curar a cárie podem conter fosfato de alumínio. Autor: Gerber Challenge. Fonte: Pixabay. Em vacinas
O alpo4 Tem sido usado há muitos anos em várias vacinas humanas para melhorar a resposta imune do corpo. Diz que alpo4 É um "adjuvante" de vacinas. O mecanismo ainda não é entendido.
Pode atendê -lo: cloreto de lítio (LiCl): propriedades, riscos e usosSabe -se que o efeito imunoestimulante de Alpo4 Depende do processo de adsorção do antígeno para o adjuvante, ou seja, a maneira como ele adere a isso. Um antígeno é um composto que, ao entrar no corpo, gera a formação de anticorpos para combater uma doença específica.
Antígenos podem ser adsorvidos ao alpo4 por interações eletrostáticas ou pela ligação com ligantes. Adsorve na superfície do adjuvante.
Também acredita -se que o tamanho das partículas alpo4 Também tem influência. Um tamanho de partícula inferior, a resposta de anticorpos é maior e mais durável.
 As vacinas podem conter fosfato de alumínio alpoo4 Para aumentar sua eficácia. Autor: Tumisu. Fonte: Pixabay.
As vacinas podem conter fosfato de alumínio alpoo4 Para aumentar sua eficácia. Autor: Tumisu. Fonte: Pixabay. Como um retardador de chama de polímero
O alpo4 Foi usado como ignipado e evite combustão ou queimado de certos polímeros.
A adição de alpo4 a um polímero de polipropileno que já possui um retardador de chama causa um efeito sinérgico entre os dois retardadores, o que significa que o efeito é muito maior que o de ambos ignriados por separados.
Quando o polímero é submetido a combustão ou queimado na presença de alpo4, Formou -se um metafosfato de alumínio que penetra na superfície carbonizada e enche os poros e rachaduras deste.
Isso leva à formação de um escudo de proteção altamente eficiente para evitar queimar ou combustão do polímero. Em outras palavras, o alpo4 selar a superfície carbonizada e impede o polímero de queimar.
 Com o alpo4 A combustão de certos polímeros pode ser atrasada. Autor: Hans Braxmeier. Fonte: Pixabay.
Com o alpo4 A combustão de certos polímeros pode ser atrasada. Autor: Hans Braxmeier. Fonte: Pixabay. Referências
- Abyzov, v.PARA. (2016). Concreto refratário leve baseado no aglutinante de alumínio-magnésio-fosfato. Proceder Engineering 150 (2016) 1440-1445. Recuperado de cientedirect.com.
- Wagh, a.S. (2016). Cerâmica de fosfato de alumínio. Em cerâmica de fosfato quimicamente ligado (segunda edição). Capítulo 11. Recuperado de cientedirect.com.
- Mei, c. et al. (2019). Vacina de fosfato de alumínio Atjuvante: Análise da composição e tamanho de ferramentas off-line e em linha. Comput Struct Biotechnol J. 2019; 17: 1184-1194. NCBI se recuperou.Nlm.NIH.Gov.
- Qin, Z. et al. (2019). Efeito da barreira sinérgica do fosfato de alumínio no polipropileno retardador de chama com base no sistema de polifosfato de amônio/dipentaerythitol. Materiais e Design 181 (2019) 107913. Recuperado de cientedirect.com.
- Vrieling, h. et al. (2019). Nanapartículas de fosfato de alumínio estabilizado usadas como vacina atjuvante. Colóides e superfícies B: Biointerfaces 181 (2019) 648-656. Recuperado de cientedirect.com.
- Schaefer, c. (2007). Drogas gastrointestinais. Antiácidos. Em drogas durante a gravidez e lactação (segunda edição). Recuperado de cientedirect.com.
- Rouquerol, f. et al. (1999). Propriedades de Som Novel Adsorbents. Em adsorção por powerders e sólidos porosos. Recuperado de cientedirect.com.
- « Notação desenvolvida o que é, exemplos e exercícios
- Origem Afro -Colombia, História, Características, Importância »

