Fator de compressibilidade Como calcular, exemplos e exercícios
- 664
- 116
- Tim Mann
Ele Fator de compressibilidade Z, o Fator de compressão para gases, é um valor adimensional (sem unidades) que é introduzido como uma correção na equação de status de gases ideal. Dessa maneira, o modelo matemático se assemelha ao comportamento observado do gás mais.
No gás ideal, a equação de estado relacionada às variáveis P (pressão), V (volume) e t (temperatura) é: P.V ideal = n.R.T com n = número de moles e r = constante dos gases ideais. Adicionando a correção do fator de compressão Z, esta equação é transformada em:
P.V = z.n.R.T
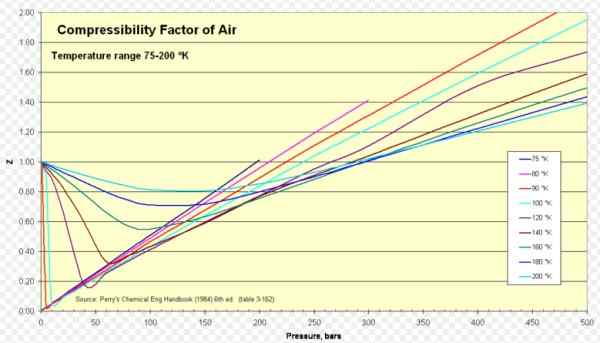
 figura 1. Fator de compressibilidade do ar. Fonte: Wikimedia Commons. https: // upload.Wikimedia.org/wikipedia/commons/8/84/compressibility_factor_of_air_75-200_k.Png.
figura 1. Fator de compressibilidade do ar. Fonte: Wikimedia Commons. https: // upload.Wikimedia.org/wikipedia/commons/8/84/compressibility_factor_of_air_75-200_k.Png. [TOC]
Como calcular o fator de compressibilidade?
Levando em consideração que o volume molar é Vlegal = V/n, Você tem o volume molar real:
P . Vreal = Z. R. T → Z = PV real/Rt
Como o fator de compressibilidade Z depende das condições do gás, ele é expresso em função da pressão e da temperatura:
Z = z (p, t)
Comparando as duas primeiras equações, observa -se que, se o número de moles n for igual a 1, o volume molar de um gás real está relacionado ao do gás ideal através de:
Vreal / Videal = Z → v real = Z videal
Quando a pressão excede as três atmosferas, a maioria dos gases para de se comportar como gases ideais e o volume real difere significativamente do ideal.
Isso percebeu em seus experimentos o físico holandês Johannes van der Waals (1837-1923), o que o levou a criar um modelo que melhor se ajustou aos resultados práticos do que a equação dos gases ideais: a equação do estado de van der Waals.
Pode atendê -lo: oxalato de sódio (Na2C2O4): estrutura, propriedades, usos, riscosExemplos
De acordo com a equação P.Vreal= Z.n.Rt, Para um gás ideal, z = 1. No entanto, em gases reais, aumentando a pressão também faz o valor de z. Isso faz sentido porque, em maiores moléculas de gás de pressão, têm mais oportunidades de colidir, portanto as forças de repulsa aumentam e, portanto, o volume.
Por outro lado, para reduzir as pressões, as moléculas se movem com maior liberdade e as forças de repulsa diminuem. Portanto, é esperado um volume mais baixo. Quanto à temperatura, quando aumenta, Z diminui.
Como van der Waals observou, nas proximidades do ponto crítico assim chamado, o comportamento do gás é muito desviado de um gás ideal.
O ponto crítico (tc, Pc) de qualquer substância são os valores de pressão e temperatura que determinam seu comportamento antes de uma mudança de fase:
-Tc É a temperatura acima do qual o gás em questão não é liquefeito.
-Pc É a pressão mínima necessária para liquefazer o gás à temperatura tc
Cada gás tem seu próprio ponto crítico, no entanto, definindo a temperatura e a pressão reduzida tr E Pr da seguinte forma:
Pr = P / pc
Vr = V /vc
Tr = T /Tc
Observa -se que um gás confinado com idêntico Vr e Tr exercer a mesma pressão Pr. Por esse motivo, se z é gráfico, dependendo de Pr para o mesmo Tr, Cada ponto nessa curva é o mesmo para qualquer gás. Isso é chamado Princípio dos estados correspondentes.
O fator de compressibilidade em gases ideais, ar, hidrogênio e água
Abaixo está uma curva de compressibilidade para vários gases em diferentes temperaturas reduzidas. Em seguida, alguns exemplos de z para alguns gases e um procedimento para encontrar z usando a curva.
Pode atendê -lo: hidrogênio: história, estrutura, propriedades e usos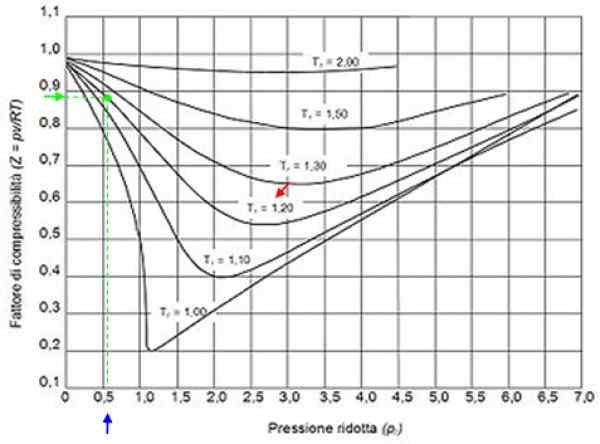 Figura 2. Gráficos de fatores gráficos para gases de acordo com a pressão de redução. Fonte: Wikimedia Commons.
Figura 2. Gráficos de fatores gráficos para gases de acordo com a pressão de redução. Fonte: Wikimedia Commons. Gases ideais
Os gases ideais têm z = 1, conforme explicado no início.
Ar
Para o ar Z é de aproximadamente 1 em uma extensa gama de temperaturas e pressões (veja a Figura 1), onde o modelo de gás ideal fornece resultados muito bons.
Hidrogênio
Z> 1 para todas as pressões.
Água
Para encontrar z da água, os valores do ponto crítico são necessários. O ponto crítico da água é: Pc = 22.09 MPA e Tc= 374.14 ° C (647.3 k). Novamente, é necessário levar em consideração que o fator de compressibilidade z depende da temperatura e pressão.
Por exemplo, suponha que você queira encontrar z da água a 500 ºC e 12 MPa. Então o primeiro é calcular a temperatura reduzida, para a qual os graus Celsius devem ser passados para Kelvin: 50 ºC = 773 K:
Tr = 773/647.3 = 1.2
Pr = 12 /22.09 = 0.54
Com esses valores que localizamos no gráfico da figura, a curva correspondente a Tr = 1.2, indicado com uma seta vermelha. Então olhamos no eixo horizontal o valor de Pr mais perto de 0.54, marcado em azul. Agora desenhamos uma vertical até interceptar a curva tr = 1.2 e finalmente é projetado a partir desse ponto para o eixo vertical, onde lemos o valor aproximado de z = 0.89.
Exercícios resolvidos
Exercício 1
Há uma amostra de gás a uma temperatura de 350 K e uma pressão de 12 atmosferas, com um volume molar 12 % maior que o previsto pela lei ideal para gases. Calcular:
a) Z fator de compressão.
b) Volume molar de gás.
Pode atendê -lo: reação irreversível: características e exemplosc) De acordo com os resultados acima, indique quais são as forças dominantes nesta amostra de gás.
Dados: r = 0,082 l.atm/mol.K
Solução para
Sabendo que v real é 12 % maior que Videal :
Vreal = 1.12Videal
Z = v real / Videal = 1.12
Solução b
P . Vreal = Z. R. T → Vreal = (1.12 x 0.082 x 350/12) l /mol = 2.14 l/mol.
Solução c
As forças de repulsão são aquelas que predominam, uma vez que o volume da amostra aumentou.
Exercício 2
Existem 10 moles de etano confinados em um volume de 4.86 l A 27 ºC. Encontre a pressão exercida pelo etano de:
a) O modelo de gás ideal
b) a equação de van der Waals
c) Encontre o fator de compressão dos resultados anteriores.
Dados para etano
Van der Waals Coeficientes:
A = 5.489 dm6. Atm . mol-2 e b = 0.06380 dm3. mol-1.
Pressão crítica: 49 atm. Temperatura crítica: 305 K
Solução para
A temperatura é passada para Kelvin: 27 º C = 27 +273 K = 300 K, lembre -se também de que 1 litro = 1 L = 1 dm3.
Em seguida, os dados fornecidos na equação de gás ideal são substituídos:
P.V = n.R.T → p = (10 x 0,082 x 300/4.86 l) atm = 50.6 atm
Solução b
A equação do estado de van der Waals é:
Onde A e B são os coeficientes dados pela declaração. Ao limpar P:
Solução c
Calculamos a pressão e a temperatura reduzidas:
Pr = 35.2/49 = 0.72
Tr = 300 /305 = 0.98 ≈ 1
Com esses valores, é procurado o valor de z no gráfico da Figura 2, descobrindo que z é aproximadamente 0.7.
Referências
- Atkins, p. 1999. Química Física. Edições Omega.
- Cengel, e. 2012. Termodinâmica. 7MA Edição. McGraw Hill.
- Engel, t. 2007. Introdução à físico -química: termodinâmica. Pearson.
- Levine, i. 2014. Princípios da física-química. 6º. Edição. McGraw Hill.
- Wikipedia. Fator de compressibilidade. Recuperado de: em.Wikipedia.org.

