Estrutura europio, propriedades, obtenha, usa

- 2613
- 302
- Alfred Kub
Ele Europio É um elemento químico pertencente às terras raras, representadas pelo símbolo químico da UE, e cujo nome é devido, evidentemente, ao continente europeu. Este é o mais reativo dos metais de terras raras, comparando lítio, cálcio e bário, e é por isso que sua difusão mineralógica é muito dispersa.
É um dos metais mais raros e caros, devido a todos os procedimentos que devem ser feitos para extrair livres de impurezas. Fisicamente, mostra um brilho dourado acinzentado, causado por sua rápida oxidação, quase é exposto ao ar. Portanto, raramente é possível armazená -lo com sua autêntica cor de prata.
 Europium oxidado. Fonte: imagens de alta resolução de elementos químicos/cc por (https: // criativecommons.Org/licenças/por/3.0)
Europium oxidado. Fonte: imagens de alta resolução de elementos químicos/cc por (https: // criativecommons.Org/licenças/por/3.0) O europium é tão reativo que deve ser armazenado em ampolas ou recipientes selados sob atmosferas de argônio inertes. Até submerso em óleo mineral é oxidado pelo pequeno oxigênio dissolvido.
Uma característica excelente do europium é sua luminescência, especialmente observada em seus compostos com o número de oxidação +3, como os EUA2QUALQUER3, que é um fósforo vermelho aplicado em infinidades de dispositivos eletrônicos e também em ingressos para euros para evitar suas falsificações.
[TOC]
Descoberta Europio
A descoberta do europium foi criada em partes, ao longo do século XIX, e em diferentes países (Suécia, Alemanha e Suíça) do continente europeu. Os íons europium eram difíceis de identificar porque seus espectros de absorção misturados com os de outros metais de terras raras, como Hill, Gadolinium e Lanthean, bem como o samário.
Portanto, a identificação e isolamento de todos esses metais arrastaram o europium como uma impureza sem caracterizar. Por exemplo, o isolamento de uma amostra pura de Cerio, em 1839 por Carl Gustav Mosander, teve como produto o reconhecimento de outros novos elementos: Lantano e Didimio.
Enquanto estudava o Didimio e a conclusão de que ele realmente consistia em uma mistura de outros elementos (Proseodymium e Neodímio), o Samario apareceu, encontrado em 1879 por Paul èmile LeCoq.
Pode servir a você: hidreto de alumínio (ALH3): estrutura, propriedades, usosMais tarde, em 1886, o químico suíço Jean Charles Galissard purificado amostras de samarium encontrando gadolinio. Lecoq para 1892 já havia estudado os espectros de Gadolinio e o de outro novo elemento.
Quinze anos depois, em 1901, o químico francês Eugène Anatole DeMarcay finalmente isolou esse novo elemento e o batizou como Europium, em homenagem à Europa.
Estrutura química do europium
Os átomos do europium permanecem unidos graças ao vínculo metálico, participando dele os elétrons de seus orbitais 4F e 6s. Como resultado de suas características eletrônicas, rádios atômicos e o modo de sua embalagem, o europium acaba adotando uma estrutura cristalina cúbica centrada no corpo (BCC), sendo um dos menos densos.
Não há fontes bibliográficas que mencionem outro polimorfo para o Europio, além da referida fase do BCC, dentro de outras faixas de temperatura; Mas sob diferentes pressões.
Por exemplo, o europium submetido a uma pressão próximo a 18 GPA adota uma estrutura hexagonal compacta e, finalmente, se transforma em uma fase monoclínica para pressões mais altas do 31.5 GPA.
Configuração eletronica
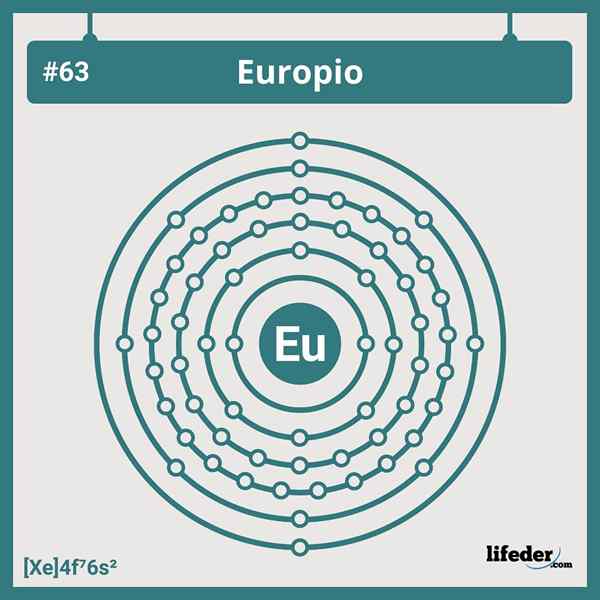 Configuração eletrônica europium
Configuração eletrônica europium A configuração eletrônica abreviada do europium é:
[Xe] 6s24f7
Estando em posição ou grupo 7 da série Lantanide, possui sete elétrons ocupando seus 4F orbitais; E, portanto, não corresponde a nenhum dos desvios que encontramos nas configurações eletrônicas para os elementos da tabela periódica.
Propriedades do Europio
Aparência física
Metal branco prateado, dureza suave semelhante à do chumbo e que fica dourada quando é exposta ao ar, cobrindo uma camada de óxido e carbonato.
Número atômico
63
Massa molar
151.96 g/mol
Ponto de fusão
826 ºC
Ponto de ebulição
1529 ºC
Densidade
Sólido: 5.264 g/cm3
No ponto de fusão: 5.13 g/cm3
Estados de oxidação
Os principais estados de oxidação do europium são +2 (UE2+) e +3 (UE3+), Sendo +1 (UE+) O menos comum dos três.
Pode atendê -lo: link covalente polar: características e exemplosEnergias de ionização
-Primeiro: 547.1 kJ/mol (UE+ gasoso)
-Segundo: 1085 KJ/mol (UE2+ gasoso)
-Terceiro: 2404 KJ/mol (UE3+ gasoso)
Eletro-negatividade
1.2 na escala Pauling.
Ordem magnética
Paramagnético
Reatividade
A reatividade do europium é comparável à do lítio e, portanto, é o metal mais reativo de terras raras. Por exemplo, reaja rapidamente com a água para formar seu hidróxido correspondente, UE (OH)3, Amarelo, que, diferentemente dos hidróxidos alcalinos, é insolúvel em água:
2 UE + 6 h2O → 2 UE (OH)3 + 3 h2
Além disso, quando queima em um oxidado mais claro para os EUA2QUALQUER3 E descartou uma chama avermelhada, remanescente da de lítio:
4 UE + 3 O2 → 2 UE2QUALQUER3
O europium é capaz de formar muitos compostos com o estado de oxidação de +2, porque possui seus orbitais F meio cheio (4f7), o que dá ao átomo uma estabilidade eletrônica incomum.
O cátion da UE2+ apresenta um comportamento químico semelhante ao de BA2+, Mas, diferentemente do último, ele atua como um agente redutor moderadamente forte, oxidando os EUA3+.
Obtenção
Matéria prima
O europium está presente em minerais de terras raras, como o Bastnasita e o monazita. No entanto, como mantém alguma semelhança com os metais alcalinos e alcalinamente em relação à sua reatividade, seus íons estão muito espalhados no córtex da Terra ao lado de minerais de cálcio ou outros metais, então não há mineral que seja rico em europium. É por isso que sua obtenção é muito cara.
Processos
Os íons da UE3+ Eles fazem parte de muitas ferrugem e fosfatos de terras raras. Portanto, o primeiro passo é separá -los dos outros metais presentes. Para fazer isso, os minerais são processados, especialmente o Bastnasita; Eles são tocados, dissolvem -se em ácidos ou bases fortes e as chuvas fracionadas são submetidas usando vários reagentes. Da mesma forma, a cromatografia de troca iônica é usada para separar os EUA3+.
À medida que o mineral é processado, um concentrado de íons da UE é obtido3+, que pode ser reduzido usando zinco metálico ou amálgama dele, para que sejam reduzidos aos EUA2+. Então os EUA2+ Coprecipita em carbonato ou sulfato de bário.
Pode atendê -lo: hidrogenação catalíticaEste precipitado é mantido e sofre uma separação para obter o óxido da UE2QUALQUER3, que é reduzido com Lantano em um caldeirão de Tantalio, para finalmente destilar e condens o Europium metálico.
Outro método para obter o europium é realizar uma eletrólise de uma mistura de eucl3 e NaCl ou CACL2 fundido. Assim, o gás de cloro ocorre no ânodo, enquanto o europio metálico é formado no cátodo.
Usa/aplicações
 A luminescência avermelhada observada neste bilhete de euro, sob uma lâmpada UV, é devido a um composto europium. Fonte: reprodir por h. GROBE/CC por (https: // criativeCommons.Org/licenças/por/3.0)
A luminescência avermelhada observada neste bilhete de euro, sob uma lâmpada UV, é devido a um composto europium. Fonte: reprodir por h. GROBE/CC por (https: // criativeCommons.Org/licenças/por/3.0) O europium em sua forma metálica carece de usos de rotina. No entanto, seus compostos são outra história, especialmente o óxido da UE2QUALQUER3, cuja fosforescência foi feita por um componente indispensável das telas nos dispositivos, monitores e televisores. Isso ocorre porque é um fósforo vermelho, emitindo uma luz vermelha característica.
A fosforescência avermelhada do Europio (III) também é usada para impedir que os ingressos euros sejam falsificados, iluminando com luz UV para confirmar sua legitimidade.
Por outro lado, quando misturados com compostos euro (ii), que são correspondências azuladas, uma luz branca é obtida, muito recorrente no copo de lâmpadas fluorescentes.
O europium é adicionado em pequenas quantidades ao aluminato de estrôncio para preparar fósforos de cores diferentes, que se destacam por ter uma fosforescência de longo prazo.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (quarta edição). Mc Graw Hill.
- Centro Nacional de Informações sobre Biotecnologia. (2020). Europium. Resumo do elemento PubChem. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Wikipedia. (2020). Europium. Recuperado de: em.Wikipedia.org
- Os editores da Enyclopaedia Britannica. (2020). Europium. Recuperado de: Britannica.com
- R. J. Marido et al. (27 de agosto de 2012). Europium-IV: um incomensuramente. Recuperado de: diários.APS.org
- David. Skowron. (26 de novembro de 2017). Para que o europium é usado para? - Usos comuns e históricos. Estudar. Recuperado de: estudo.com
- Dr. Doug Stewart. (2020). Fatos do elemento europium. Recuperado de: Chemicool.com
- « Origem do monoteísmo, características e religiões
- Conceito de diferenças culturais e exemplos entre países »

