Estrutura de estanho, propriedades, obtenção, usa

- 1370
- 49
- Gilbert Franecki
Ele lata É um metal pertencente ao bloco p da tabela periódica, cujo símbolo químico é SN, e que está localizado no grupo 14, o carbono. Apesar de ser um metal amplamente usado em toda a humanidade desde os tempos antigos, a verdade é que é um metal escasso na crosta terrestre (2.3 ppm).
É um metal prateado, macio, dúctil e maleável. Possui um número atômico de 50, e seus estados predominantes ou números de oxidação são +2 (SN2+) e +4 (SN4+), Sendo os compostos de estanho (ii), como o SNCl2, Bons agentes redutores.
 TIN AOTROPOS. Fonte: Zinn_9.JPG: De: Usuário: Tomihahndorf.Trabalho derivado: MaterialScientist/CC BY-S (https: // criativeCommons.Org/licenças/BY-SA/2.0)
TIN AOTROPOS. Fonte: Zinn_9.JPG: De: Usuário: Tomihahndorf.Trabalho derivado: MaterialScientist/CC BY-S (https: // criativeCommons.Org/licenças/BY-SA/2.0) A lata tem como um símbolo SN, que é uma abreviação da palavra latina "Stannum". O estanho é um metal resistente ao ataque de água e ao ar à temperatura ambiente; Mas no ar quente forma dióxido de lata, Snam2.
A propriedade de ser resistente à corrosão e ter um ponto de fusão baixo, serviu para ter inúmeras aplicações; como o revestimento de superfícies de metal e soldagem.
A lata tem duas formas alotrópicas principais: a forma β branca e sólida; e os contextos α, cinza e normalmente empoeirado (mais quebradiço). Portanto, a forma β é a mais usada em aplicações de estanho.
Outra propriedade importante da lata é sua capacidade de fazer parte de ligas com vários metais, sendo o mais antigo bronze, uma liga de cobre e lata.
[TOC]
Descoberta
 Grânulos de lata. Fonte: Nephronus, CC0, via Wikimedia Commons
Grânulos de lata. Fonte: Nephronus, CC0, via Wikimedia Commons Estanho é um metal conhecido desde os tempos antigos. Portanto, não se sabe quem era seu descobridor; E muito menos, o ano e o lugar de sua descoberta.
Bronze é uma liga de cobre com estanho e arsênico. É possível que a elaboração dessa liga seja uma conseqüência de um fato fortuito e não intencional, uma vez que os primeiros objetos de bronze - na Idade do Bronze - foram formados por cobre e apenas traços de arsênico.
Esses objetos apareceram no Oriente Próximo, onde o arsênico está associado ao cobre. Mas desde o início a toxicidade do arsênico foi evidenciado, alcançando sua substituição2).
Os gregos antigos obtiveram estanho pelo comércio marítimo e se referiram à fonte de sua lata como "os Cassiterides", que significa 'ilhas de lata'. É possível que essas ilhas estivessem localizadas em Cornuelles, British ou Espanha, onde há grandes depósitos de lata.
Pode atendê -lo: subsalicilato de bismuto: estrutura, propriedades, usos, efeitosEstrutura de lata química
Quando há dois muitos: a lata branca ou β-sn e a lata cinza ou α-sn, teremos duas estruturas cristalinas. O β-Sn é tetragonal centrado no corpo (BCT), que caracteriza a maleabilidade da lata branca.
Enquanto isso, a estrutura do α-SN é diamante; isto é, os átomos de SN estão ligados formando redes tetraedradas, sem a existência de uma ligação de metal.
A lata também apresenta outros dois outros em diferentes condições de pressão (na ordem do GPA) e a temperatura (acima de 161 ºC): σ-sn e γ-sn.
Configuração eletronica
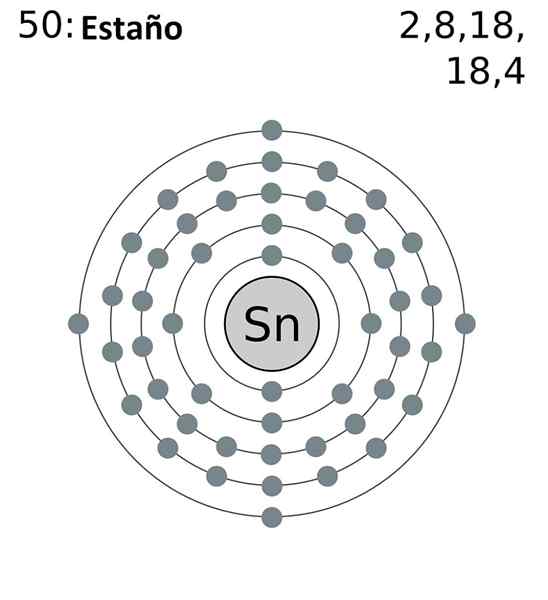
A configuração eletrônica abreviada de estanho é a seguinte:
[KR] 4D10 5s2 5 p2
Adicionando todos os elétrons, teremos um total de 14, o mesmo número que corresponde ao seu grupo. No entanto, apenas os elétrons dos orbitais 5s e 5p são aqueles que participam das reações químicas da lata, uma vez que as do 4D não estão energeticamente disponíveis.
Propriedades de lata
Aparência e características físicas
O estanho é um metal macio, dúctil e maleável, que pode ser frio e girando. Seu baixo ponto de fusão permite aderir a superfícies limpas de metais ou ligas como aço, cobre e suas ligas, protegendo -as da oxidação.
Quando uma peça de lata é dobrada, ele corta, emitindo um som característico conhecido como "grito de lata", uma conseqüência do esmagamento dos cristais.
Tin tem duas formas alotrópicas: β e α. A forma β corresponde a um sólido branco e é responsável por aplicações de estanho; Enquanto o formulário α é um pó acinzentado.
 Localização de lata na tabela periódica. Fonte: Imagem de Daniel Mayer ou Greatpatton e lançado em Termos do GNU FDL
Localização de lata na tabela periódica. Fonte: Imagem de Daniel Mayer ou Greatpatton e lançado em Termos do GNU FDL A forma β é apresentada em temperaturas acima de 13.2 ºC. Quando a temperatura cai 13.2 ºC, a lata muda de forma β para o formulário α. Esse fenômeno é indesejável e é evitado adicionando outros metais à lata, como antimônio ou bismuto, que bloqueiam essa mudança e prolongando sua vida útil.
Tin é o primeiro supercondutor conhecido em temperaturas abaixo de 3.72 k.
Número atômico
cinquenta
Massa molar
118.71 g/mol
Ponto de fusão
231.93 ºC
Ponto de ebulição
2602 ºC
Densidade
Alotropo β: 7.265 g/cm3
Alotropo α: 5.769 g/cm3
Estados de oxidação
TIN tem vários estados de oxidação: -4, -3, -2, -1, 0, +1, +2, +3, +4, +4. No entanto, a maioria de seus compostos tem a lata com estados de oxidação +2 (SN2+) e +4 (SN4+).
Pode atendê -lo: compostos orgânicosEnergias de ionização
Primeiro: 708.6 kJ/mol
Segundo: 1411.8 kJ/mol
Terceiro: 2943.0 kJ/mol
Eletro-negatividade
1.96 na escala Pauling
Reatividade
O estanho é um metal resistente à ação do ar e da água à temperatura ambiente, mas quando é aquecida no ar, forma o óxido de lata (IV), Snam2, que é fracamente ácido. É atacado por ácidos e álcalis, e na presença de oxigênio pode atuar em alguns casos como um catalisador.
Obtenção
 Casiterite Mineral é a principal fonte mineralógica de estanho. Fonte: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0)
Casiterite Mineral é a principal fonte mineralógica de estanho. Fonte: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0/CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0) A lata, do ponto de vista de sua ocorrência, é um metal raro, pois tem uma abundância na casca da terra de apenas 2 ppm. Casiterite Mineral, um mineral de óxido de lata, é a única fonte comercial de lata.
O Casiterite é um mineral escuro encontrado em terrenos lamacentos nas margens dos rios. A lata é extraída do casiterito, aquecendo até 1370 ºC com carvão ou coque para produzir sua redução.
A lata produzida é impura, por isso é tratada com hidróxido de sódio ou ácido clorídrico para solubilizar a lata. Então, isso é submetido a eletrólise, sendo o ânodo de lata e o cátodo de ferro. A lata é depositada no cátodo, com uma pureza superior a 90%.
Usa/aplicações
Proteção contra corrosão
Estanho é metal resistente à corrosão. A lata ou a lata de So So So é um recipiente de aço, coberto com uma camada de lata para evitar oxidação.
As latas foram usadas para armazenar comida e outras substâncias, por exemplo: pinturas, lacas, solventes, etc. Mas eles estão sendo substituídos atualmente por recipientes de alumínio ou plástico. Tubos e válvulas revestidas de estanho mantêm água e pureza de bebida.
Ligas
 Os primeiros usos para ligas de lata foram fabricar recipientes ou utensílios, como latas e jarros desta despensa. Fonte: Butterfly Voyages - Serge Ouachée/CC por -sa (https: // CreativeCommons.Org/licenças/BY-SA/3.0)
Os primeiros usos para ligas de lata foram fabricar recipientes ou utensílios, como latas e jarros desta despensa. Fonte: Butterfly Voyages - Serge Ouachée/CC por -sa (https: // CreativeCommons.Org/licenças/BY-SA/3.0) O homem começou a usar bronze por mais de 5000 anos. O bronze é uma liga de cobre e estanho que é usada na elaboração de ferramentas, armas, utensílios domésticos.
Da mesma forma, a casca, uma liga que era inicialmente de lata e chumbo, foi usada para fazer vasos, pratos, etc. Mas devido à toxicidade de chumbo, Peel é atualmente fabricado com lata, antimônia e liga de cobalto.
Pode servir a você: ácido hipóiodoso (HIO)A liga de lata e o chumbo têm um ponto de fusão baixo, propriedade que permitiu seu uso na soldagem, uma técnica que serve para montar peças presentes em circuitos elétricos e eletrônicos. Existem carros nos quais a lata é liga com ferro, enquanto eles são usados em veículos aeroespaciais, alumínio, lata e ligas de titânio.
As ligas de circulium, também chamadas de zircaloys, são usadas em reatores nucleares e têm uma pequena quantidade de lata.
 Amostras de lata. Fonte: Ondřej Mangl, domínio público, via Wikimedia Commons
Amostras de lata. Fonte: Ondřej Mangl, domínio público, via Wikimedia Commons A liga de prata e lata tem sido usada em amálgamas dentárias.
Uma liga cristalina com o elemento Niobio é um supercondutor que funciona a uma temperatura de 18 K e mantém sua propriedade em um forte campo magnético.
Vidro
A lata é usada no procedimento Pilkington para produzir vidro de janela. O vidro fundido é colocado em uma superfície de estanho fundido, adquirindo o vidro uma superfície lisa e lisa. Esta técnica ainda é usada com sucesso.
Os sais de lata são pulverizados no vidro para obter um forro de energia condutor, sendo capaz de usar para fazer painéis de iluminação e pára -brisa sem gelo.
Compostos de lata
Cloreto pecaminoso (SNCl2) É usado em estanho galvanizado e como um agente redutor na fabricação de polímeros e corantes. Fluoreto de lata (SNF2) É um ingrediente ativo em pastas dentárias.
Enquanto isso, seu óxido é um catalisador útil em certos processos industriais. Além disso, é usado como pó para polir aço.
Os compostos de lata orgânicos são usados como biocidas e fungicidas, sendo tóxicos para os humanos. Os estabilizadores de lata orgânicos são usados para evitar mudanças no cloreto de polivinil devido à exposição à luz e ao calor.
O cloreto isñico (SNCl4) é usado como um estabilizador de perfume e como material de partida para outros sais de lata.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (quarta edição). Mc Graw Hill.
- Wikipedia. (2020). Lata. Recuperado de: em.Wikipedia.org
- Centro Nacional de Informações sobre Biotecnologia (2020). Lata. Resumo do PubChem Comunund para CID 23974. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Dr. Doug Stewart. (2020). Fatos de elemento de lata. Recuperado de: Chemicool.com
- Os editores da Enyclopaedia Britannica. (2020). Lata. Recuperado de: Britannica.com
- Bell, Terence. (26 de agosto de 2020). As propriedades, produção e aplicações de estanho. Recuperado de: pensamento.com
- Lentech b.V. (2020). Lata. Recuperado de: lentech.com
- Stephanie Pupas. (28 de julho de 2015). Fatos sobre Tin. Recuperado de: LiveScience.com
- Anais da Conferência da AIP. (9 de fevereiro de 2018). Recuperação de estanho da escória de lata usando o método de eletrólise. doi.org/10.1063/1.5024070

