Espectro de absorção

- 3819
- 893
- Tim Mann
 Espectro de luz visível. Fonte: Wikimedia Commons
Espectro de luz visível. Fonte: Wikimedia Commons O que é um espectro de absorção?
A Espectro de absorção É o produto da interação da luz com um material ou substância em qualquer um de seus estados físicos. A interação inclui um amplo segmento da faixa de comprimentos de onda e energia da radiação eletromagnética.
Em outras palavras, o espectro de absorção reflete essa fração de radiação eletromagnética que um certo material absorve em uma faixa de frequência.
Nesse sentido, alguns sólidos, líquidos ou gases podem absorver fótons de diferentes energias ou comprimentos de onda, da radiação ultravioleta, seguida de luz visível, a radiação ou luz infravermelha, cambaleando nos comprimentos de onda de microondas.
O olho humano percebe apenas as interações da matéria com luz visível. Também é capaz de contemplar a difração da luz branca através de um prisma ou um meio em seus componentes coloridos (imagem superior).
Se o raio de luz for "captura" depois de viajar por um material e analisado, a ausência de certas bandas coloridas seria encontrada. Isto é, listras negras seriam observadas contrastando com seu fundo.
Este é o espectro de absorção, e sua análise é fundamental na química e astronomia analíticas instrumentais.
Absorção atômica
Na imagem superior, é mostrado um espectro de absorção típico dos elementos ou átomos. Observe que as listras pretas representam os comprimentos de onda absorvidos, enquanto os outros são emitidos. Isso significa que, pelo contrário, um espectro de transmissão atômica pareceria uma banda preta com cores emitidas.
Mas quais são essas listras? Como saber se os átomos absorvem ou emitem (sem introduzir fluorescência ou fosforescência)? As respostas estão nos estados eletrônicos permitidos pelos átomos.
Pode servir a você: fórmula mínima: como obter a fórmula, exemplos e exercícios mínimosTransições eletrônicas e energia
Os elétrons são capazes de se afastar do núcleo, deixando -o carregado positivamente enquanto viaja de um orbital de menor energia para uma de maior energia. Para fazer isso, explicado pela física quântica, absorve fótons de energia específica para realizar a referida transição eletrônica.
Portanto, a energia é quantizada e não absorverá meio ou três quartos de um fóton, mas os valores de frequência (ν) ou comprimentos de onda de concreto (λ).
Uma vez excitado o elétron, ele não permanece ilimitado no estado eletrônico de maior energia. Libere energia na forma de um fóton e o átomo retorna ao seu estado basal ou original.
Dependendo se os fótons absorvidos forem registrados, haverá um espectro de absorção. E se os fótons emitidos forem registrados, o resultado será um espectro de emissão.
Este fenômeno pode ser observado experimentalmente se amostras macias ou atomizadas forem aquecidas a partir de um elemento. Na astronomia, comparando esses espectros, a composição de uma estrela pode ser conhecida e até sua localização relacionada à terra.
Espectro visível
Como pode ser visto na imagem, o espectro visível inclui cores de violeta ao vermelho e todas as suas tonalidades em relação ao quanto o material absorve (nuances escuras).
Os comprimentos de onda da luz vermelha correspondem a valores de 650 nm em diante (até desaparecer na radiação infravermelha).
E na extremidade esquerda, os tons violeta e roxa cobrem os valores do comprimento de onda de até 450 nm. O espectro visível abrange de 400 a aproximadamente 700 nm.
À medida que λ aumenta, a frequência do fóton diminui e, portanto, sua energia. Assim, a luz violeta tem maior energia (comprimentos de onda mais baixos) do que a luz vermelha (comprimentos de onda mais altos).
Pode atendê -lo: bromo: história, estrutura, configuração eletrônica, propriedades, usosPortanto, um material que absorve a luz roxa implica transições eletrônicas de maiores energias.
Quando o material absorve a cor violeta, ele usará uma cor amarela esverdeada, o que significa que seus elétrons realizam transições de energia muito. E quando o material absorve a cor vermelha, de menos energia, reflete uma cor verde azulada.
Quando um átomo é muito estável, geralmente apresenta estados eletrônicos muito distantes em energia e, portanto, precisará absorver fótons de maior energia para permitir transições eletrônicas:
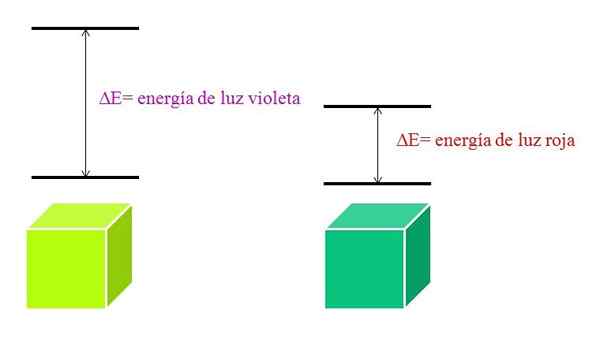 Esquema das energias da luz violeta e luz vermelha. Fonte: Gabriel Bolívar
Esquema das energias da luz violeta e luz vermelha. Fonte: Gabriel Bolívar Espectro de absorção de moléculas
As moléculas têm átomos, e estes também absorvem a radiação eletromagnética. No entanto, seus elétrons fazem parte da ligação química, portanto suas transições são diferentes. Um dos grandes triunfos da teoria orbital molecular é poder relacionar os espectros de absorção com a estrutura química.
Assim, links simples, duplos, triplos, conjugados e estruturas aromáticas, têm seus próprios estados eletrônicos, absorvendo fótons muito específicos.
Ao possuir vários átomos, além das interações intermoleculares e das vibrações de seus links (que também absorvem energia), os espectros de absorção de moléculas têm a forma de "montanhas", que indicam as bandas que incluem os comprimentos de onda onde as transições eletrônicas.
Graças a esses espectros, um composto pode ser caracterizado, identificar e até por meio de análise multivariada, quantificá -lo.
Azul de metileno
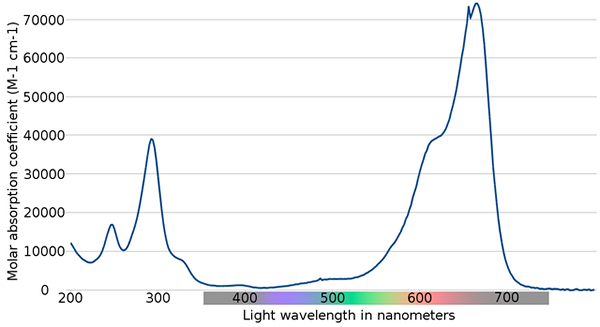 Espectro azul de metileno. Fonte: Wikimedia Commons
Espectro azul de metileno. Fonte: Wikimedia Commons Na imagem superior, o espectro do indicador de metileno azul é mostrado. Como o seu nome aponta, é azul, mas pode ser verificado com seu espectro de absorção?
Pode atendê -lo: mudanças físicasObserve que existem faixas entre os comprimentos de onda de 200 e 300 nm. Entre 400 e 500 nm, quase não há absorção, ou seja, não absorve as cores violeta, azul ou verde.
No entanto, apresenta uma intensa banda de absorção após 600 nm e, portanto, possui transições eletrônicas de baixa energia que absorvem fótons da luz vermelha.
Consequentemente, e dados os altos valores de absorvidades molares, o azul de metileno exibe uma cor azul intensa.
Clorófilos A e B
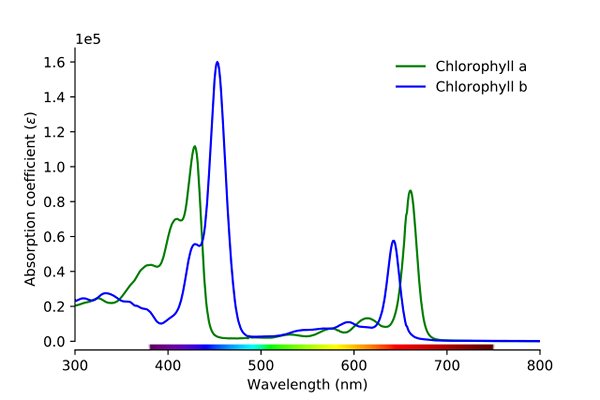 Espectro de absorção de clorofila A e B. Fonte: Wikimedia Commons
Espectro de absorção de clorofila A e B. Fonte: Wikimedia Commons Como pode ser visto na imagem, a linha verde corresponde à clorofila um espectro de absorção, enquanto a linha azul corresponde à de clorofila B.
Primeiro, as bandas onde as absorvidades molares são maiores, neste caso, aquelas que estão à esquerda, entre 400 e 500 nm. Clorofila uma cor roxa intensamente absorvente, enquanto a clorofila b (linha azul) faz isso com cor azul.
Ao absorver a clorofila B em torno de 460 nm (azul), a cor amarela é refletida. Por outro lado, também absorve intensamente, cerca de 650 nm, luz de laranja, o que significa que exibe a cor azul. Se amarelo e azul são misturados, resulta em cor verde.
E, finalmente, a clorofila e absorve a cor violeta azulada e também uma luz vermelha em torno de 660 nm. Portanto, exibe uma cor verde "macia" por amarelo.
Referências
- Observatoire de Paris (S.F.). Os diferentes tipos de espectros. Recuperado em média 4.Osppm.fr
- Campus da Universidade Ranals (S.F.). Espectrofometria: espectros de absorção e quantificação colorimétrica de biomoléculas. UCO se recuperou.é

