Entalpía
- 4176
- 472
- Mr. Reginald Lindgren
O que é entalpia?
O entalpía É uma propriedade termodinâmica cuja variação, sob condições constantes de temperatura e pressão, determina a energia calórica de uma substância ou sistema associado a uma reação química ou processo físico. Sendo uma função de estado, é representado com a letra no capital H, sendo ΔH sua variação.
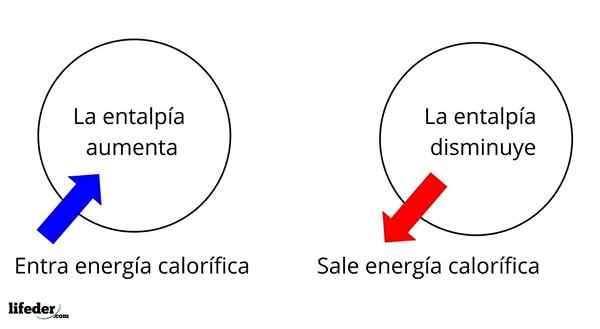
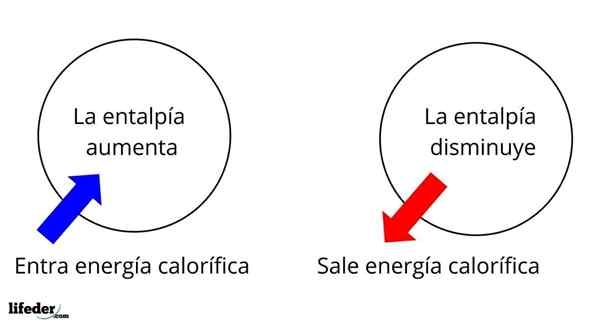
É uma das propriedades extensas mais fundamentais para estudar a termoquímica de muitas reações; isto é, falamos sobre o desapego ou absorção de calor entre o meio de reação e seus arredores. Assim, dizemos que uma reação é exotérmica se seu ΔH for negativo (ΔH 0).
 A mudança de entalpia no derretimento do gelo é positiva, indicando que o gelo absorve o calor do ambiente para se mover para o estado líquido, a água
A mudança de entalpia no derretimento do gelo é positiva, indicando que o gelo absorve o calor do ambiente para se mover para o estado líquido, a água Gelo, por exemplo, tem uma entalpia, hgelo, Enquanto a água também tem sua própria entalpia, Hágua. Quando o gelo derrete, ocorre uma variação de entalpia, chamada ΔHFus ou calor derretido (hágua-Hgelo). A entalpia da água é superior ao gelo, causando ΔHFus Pois o gelo é positivo e tem um valor +6.01 KJ/mol.
Entalpia e sua variação geralmente são expressas em unidades de joule ou calorias. A mudança de entalpia +6.01 kj/mol indica que um mol de gelo deve absorver 6.01 KJ de energia calórica ou calor para derreter.
Como o entalpia é calculado?
Entalpia e sua variação
A própria entalpia é incalculável, porque depende de variáveis difíceis de medir exatamente. Uma boa comparação seria querer medir o volume total dos oceanos: sempre haverá partes dela sob a terra ou espalhadas entre os continentes. Portanto, e na prática, H não pode ser determinado; Mas sim Δh.
Pode atendê -lo: colóidePara atingir uma expressão matemática que permite o cálculo de ΔH, deve -se primeiro a ser deixada da definição fundamental de entalpia:
H = u + PV
Sendo a energia interna do sistema ou a substância em questão, e PV o trabalho de volume de pressão que este sistema exerce sobre o ambiente para existir. Como estamos interessados em calcular ΔH e não h, temos:
ΔH = ΔU + δ (PV)
Se a pressão for constante, a equação permanecerá:
ΔH = ΔU + pΔV
Sabemos por outro lado que:
ΔU = q + C
Ser q calor e trabalho. Substituindo -nos:
ΔH = q + W + pΔV
Mas, além disso, sabemos disso:
W = - pΔV
E, por conseguinte:
ΔH = q - PΔV + pΔV
ΔH = q
Isto é, o ΔH para uma reação ou processo, realizado sob pressão constante, será igual ao calor q gerado ou absorvido.
Reações mudanças de entalpia
A suposição de que a pressão permanece constante é possível se a reação ocorrer sob a atmosfera da Terra. Por exemplo, o gelo das paisagens de inverno derrete sem experimentar outra pressão que a de nossa atmosfera. Por outro lado, também se aplica a reações em meios líquidos ou aqueles que não produzem grandes quantidades de gases.
Essas reações absorvem ou liberam calor q Igual a ΔH, que por sua vez, é a diferença de entalpias entre produtos e reagentes:
ΔH = hProdutos - HReagentes
Tipos de entalpia
É uma prática comum falar sobre ΔH e h como se fossem iguais: ambos são chamados de entalpias. No entanto, quando se trata dos tipos, H é único para cada substância ou sistema; Enquanto ΔH, por outro lado, está sujeito à natureza da reação ou processo em si mesma.
Nesse sentido, primeiro temos variações de entalpia positiva (ΔH> 0) ou negativas (ΔH <0); unas corresponden a los procesos o reacciones endotérmicos (se enfrían los alrededores), mientras las segundas tienen que ver con los procesos o reacciones exotérmicos (se calientan los alrededores).
Pode atendê -lo: nitrobenzeno (c6h5n2): estrutura, propriedades, usos, riscosO sinal '+' ou '-' que acompanha ΔH nos diz, portanto, se houver libertação ou absorção de calor em uma certa reação ou processo; que têm suas características ΔH, como parte de suas propriedades termoquímicas.
Temos infinitos de tipos de entalpias, que podem ser classificadas de acordo com processos físicos ou reações químicas.
Processos físicos
Entalpia de mudança de fase
As substâncias precisam absorver ou liberar calor para se mover de uma fase de material ou material (sólido, líquido ou gás) para outro. Por exemplo, o gelo absorve o calor para derreter, tão entalpia para essa mudança de fase corresponde à fusão, ΔHFus, Também chamado de calor latente de calor.
Entalpia de dissolução ou mistura
As substâncias quando dissolvidas ou misturadas em um meio solvente podem absorver ou liberar calor, com uma entalpia ΔHDis ou ΔHMisturar.
Reações químicas
Entalpia de treinamento
É o calor associado, ΔHºF, à formação de um composto, especificamente uma toupeira, de seus elementos constituintes em condições padrão de pressão e temperatura (t = 298.15 K e P = 1 atm).
Entalpia de decomposição
É o calor associado, ΔHdes, para a degradação de um composto em substâncias menores e simples. Geralmente é positivo, porque o calor é necessário para quebrar os laços das moléculas.
Entalpia de hidrogenação
É o calor associado, ΔHh, Ao vício de uma molécula de hidrogênio a um composto, geralmente um hidrocarboneto.
Entalpia de combustão
É o calor liberado, ΔHpentear, Quando uma substância queima reagindo com oxigênio. É negativo, porque o calor e a luz são liberados (fogo).
Pode atendê -lo: massa atômica: definição, tipos, como calculá -lo, exemplosExemplos de entalpias
Finalmente, será feita menção a alguns exemplos específicos de entalpias:
Combustão de metano
CH4 + 22 → co2 + 2h2QUALQUER
ΔH = -890.3 kJ/mol
Isto é, um mol de Cho4 Quando a combustão liberta 890.3 kJ de energia calórica.
Hidrogenação do etileno
CH2= Cap2 + H2 → cap3CH3
ΔH = -136 KJ/mol
Uma toupeira de etileno libera 136 kJ de calor quando hidrogênio para se tornar um etano.
Sal na água
Sal de mesa, NaCl, dissolve -se na água para separar os íons Na+ e cl- de redes cristalinas e surround (hidrato) de moléculas de água:
NaCl (s) → Na+(AC) + CL-(AC)
ΔH = +3.87 kJ/mol
Isto é, dissolvendo sal na água, de acordo para esfriar o vidro ou o recipiente. No entanto, a quantidade absorvida de calor é muito pequena, então nossas mãos só sentirão uma ligeira mudança de temperatura.
Dissolução de clorato de potássio na água
Por outro lado, o clorato de potássio, KCLO3, Tem um ΔhDis muito positivo:
KCl3(S) → K+(AC) + CLO3-(AC)
ΔH = +41.38 kJ/mol
O que significa que se dissolver na água, ele absorve muito quente. E, portanto, o recipiente esfriará significativamente e veremos que o vapor de água circundante umedecerá sua superfície externa.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Wikipedia. (2020). Entalpia. Recuperado de: em.Wikipedia.org
- Helmestine, Anne Marie, Ph.D. (28 de agosto de 2020). Definição de entalpia em química e física. Recuperado de: pensamento.com
- Andrew Rader Studios. (2015). Energia e entalpia. Recuperado de: física4kids.com
- Kiddle. (2020). Fatos de entalpia para crianças. Recuperado de: Fatos.Kiddle.co
- Admin. (21 de dezembro de 2010). A entalpia. Recuperado de: químico oxiorgânico.com
- María Estela Raffino. (11 de julho de 2020). Conceito de entalpia. Recuperado de: conceito.de

