Vínculo covalente triplo
- 1906
- 254
- Terrence King IV
Explicamos o que é um link triplo, suas características e damos vários exemplos
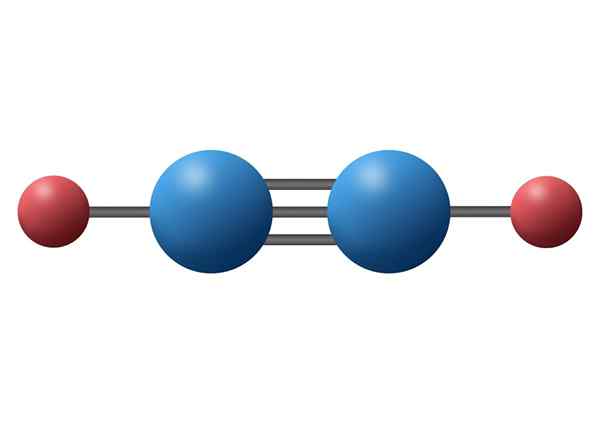 Molécula de acetileno (C2H2) com sua ligação tripla entre os dois átomos de carbono
Molécula de acetileno (C2H2) com sua ligação tripla entre os dois átomos de carbono O que é um link covalente triplo?
O ligações covalentes triplas São links químicos nos quais dois átomos compartilham três pares de elétrons. Em outras palavras, são ligações covalentes formadas por um total de seis elétrons de valência que giram em torno de dois átomos.
Existem muitos compostos químicos que contêm links triplos. Por exemplo, compostos orgânicos, como alcinnes, contêm ligações covalentes triplas C-C. Os nitriles também são caracterizados por ter um grupo que contém um carbono ligado ao nitrogênio por meio de uma ligação covalente C-N tripla. Outros compostos inorgânicos, como o nitrogênio molecular no ar, também contêm ligações covalentes triplas.
Ter 6 elétrons girando em torno de dois núcleos fornecem links triplos muitas características específicas. Tanto a forma das moléculas que as contêm quanto as reações químicas em que podem participar são diferentes das de ligações duplas ou simples.
Características de link covalente triplo
Eles são formados por 6 elétrons
Essas ligações são formadas por 6 elétrons e são formadas quando cada um dos dois átomos envolveu compartilhamentos três de seus elétrons desaparecidos com o outro. Esta é a razão pela qual eles são chamados de links triplos, pois têm triplicar o número de elétrons da ligação covalente simples.
Eles têm um link sigma (σ) e dois links PI (π)
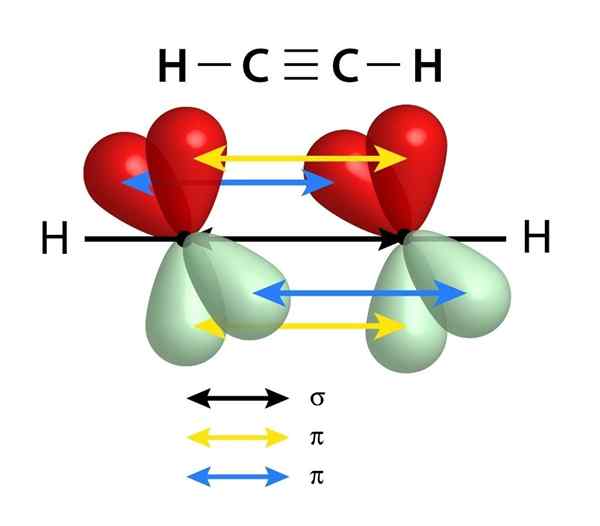 Esquema dos links que compõem uma ligação tripla entre dois átomos de carbono. A seta preta do centro representa o link sigma, enquanto o amarelo e o azul representam cada uma das duas ligações PI
Esquema dos links que compõem uma ligação tripla entre dois átomos de carbono. A seta preta do centro representa o link sigma, enquanto o amarelo e o azul representam cada uma das duas ligações PI Semelhante às ligações duplas, os links triplos também são formados por um link sigma que passa pelo centro da linha que se junta aos dois átomos vinculados. No entanto, diferentemente dos links duplos que têm um, os links triplos têm dois links PI, além do link Sigma.
Pode servir a você: cloreto de cobre (i) (CUCL): estrutura, propriedades, usosEles quase sempre formam compostos lineares
Quando dois átomos de carbono formam um link triplo, cada um ainda tem a possibilidade de formar um link simples adicional com outro átomo (já que o carbono pode formar 4 ligações no total).
Nesses casos, os dois carbonos e os outros dois átomos ligados a eles formarão uma linha reta. Esta forma que a molécula adquira é chamada de geometria linear.
Eles são os títulos covalentes mais fortes
Ao comparar os links triplos entre dois átomos com as ligações duplas e simples entre os mesmos átomos, observa -se que os links triplos são sempre mais fortes do que os outros tipos de ligação covalente. Isso significa que é mais difícil quebrar um link triplo do que um duplo ou simples.
Isso ocorre porque, além disso, tendo que quebrar o link sigma (que também está presente em ligações simples e duplas), nenhum deve quebrar (como em links duplos), mas duas ligações PI adicionais.
Eles são mais curtos que as ligações duplas ou que simples
Devido ao mesmo fato de serem links mais fortes, os links triplos gerenciam.
Eles representam duas insatação
Cada carbono com uma ligação tripla terá apenas um link adicional com outro átomo. Isso significa que esse carbono estaria ligado apenas a dois átomos, em vez de quatro, por isso tem menos hidrogênio do que poderia possuir se apenas formassem ligações simples.
Pode atendê -lo: heptano (c7h16): estrutura, propriedades e usosIsso é chamado de insaturação, e os compostos com links triplos têm duas insatação, uma vez que cada um dos dois carbonos se encaixaria em 2 hidrogênios adicionais, se não fosse o link triplo.
São links rígidos
Como ligações duplas, os links triplos são rígidos e difíceis de dobrar ou torcer. Isso se deve à maior força do link e ao menor comprimento.
Eles podem agir como bases
Alguns compostos com links triplos podem usar os elétrons PI do referido link para vincular ou aceitar íons h+, Portanto, agindo como bases.
Eles podem hidrogená -los para dar links duplos ou simples
A insaturação do link triplo pode ser removida quebrando as ligações PI e adicionando hidrogênios aos dois carbonos. Isso é chamado de hidrogenação. Se apenas uma molécula de hidrogênio para uma ligação tripla for adicionada, ela se tornará uma ligação dupla. Se duas moléculas de hidrogênio forem adicionadas, ele se tornará um vínculo simples.
Exemplos de links covalentes triplos
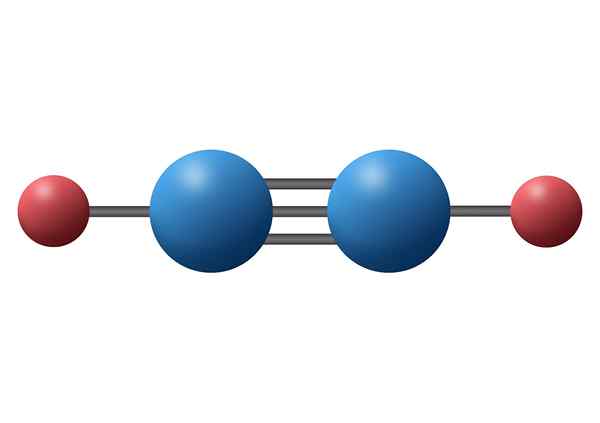
Molécula de nitrogênio (N2)
A molécula de nitrogênio contém uma ligação covalente tripla entre os dois átomos de nitrogênio. Cada átomo compartilha seus três elétrons de valência desapareceu com o outro, e cada novo par de elétrons se torna a ligação sigma ou uma das duas ligações Pi que a molécula possui.
 Molécula de nitrogênio
Molécula de nitrogênio Nesse caso, os dois átomos de nitrogênio e os pares de elétrons ilesos que cada um deles estão localizados ao longo de uma linha reta.
O adequado (um alcino da fórmula C3H4)
O apropriado é o segundo alcino mais simples que existe. Este composto é composto de uma cadeia de três carbonos, dois dos quais estão ligados através de um link covalente triplo.
Pode atendê -lo: hidrocarbonetos insaturados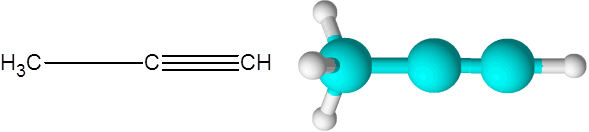 Molécula de Proiner
Molécula de Proiner Aqui você também pode ver que os três carbonos e o último átomo de hidrogênio (aquele à direita) formam uma linha reta. No modelo, também pode ser visto que o link C-C simples é mais longo que o link triplo C-C.
Monóxido de carbono (CO)
O monóxido de carbono é um gás inorgânico tóxico que possui um átomo de carbono negativo e oxigênio positivo ligado por meio de uma ligação covalente tripla. Nesse caso, é uma ligação polar, devido à diferença nas eletronegatividades entre carbono e oxigênio.
 Molécula de monóxido de carbono
Molécula de monóxido de carbono

