Ligação covalente
- 3623
- 1073
- Mr. Reginald Lindgren
O que é um link covalente?
A ligação covalente é uma interação forte que permite que dois ou mais átomos se juntem para formar moléculas. Este é um dos tipos de ligações químicas nas quais participam de alguns elétrons que provêm dos orbitais mais externos dos átomos que estão ligados.
Em teoria, cada átomo contribui com um dos dois elétrons ao vincular covalentemente, para que eles ganhem estabilidade. O par de elétrons, que se torna uma espécie de "gancho eletrônico" entre os dois núcleos atômicos, é compartilhado igualmente entre dois átomos idênticos, mas isso não acontece quando os dois átomos são de dois elementos diferentes.
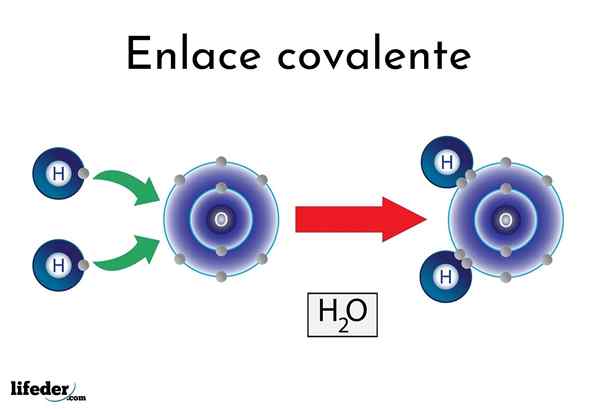
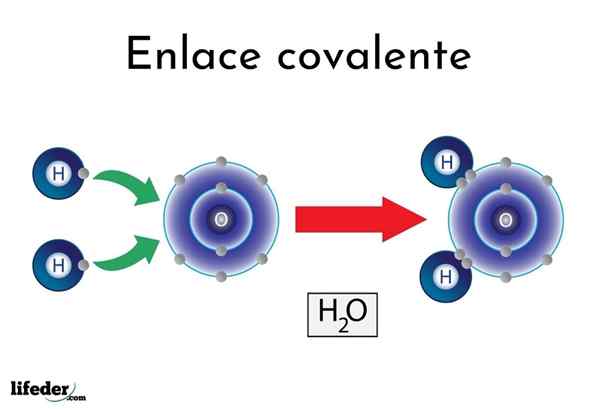 Vínculo covalente da água
Vínculo covalente da água Existem átomos ou elementos que têm uma tendência natural de produzir elétrons, enquanto outros preferem conquistá -los.
Por exemplo, a famosa molécula de água, h2Ou, tem dois links covalentes: h-o-h. Hidrogênios e oxigênio compartilham os dois pares de elétrons, mas estes orbitam mais perto do átomo de oxigênio do que o hidrogênio. Este fenômeno é devido à polaridade e à eletronegatividade.
Características de ligações covalentes
As ligações covalentes apresentam as seguintes características:
-Eles envolvem alguns elétrons para cada ligação covalente.
-Seus comprimentos são geralmente expressos em unidades de PM (Picometers) ou Armstrong (Å).
-Eles são difíceis de quebrar, o que significa que são muito fortes.
-Quando eles quebram, ocorrem mudanças ou transformações químicas, uma vez que a molécula está perdendo átomos. Nesse processo, a energia é absorvida.
-Quando eles se formam, nasce uma nova molécula. Neste processo, a energia é liberada.
Pode servir a você: reações químicas: características, peças, tipos, exemplos-Seus comprimentos variam de acordo com a avidez que um dos átomos vinculados tem em relação ao par de elétrons; Isto é, quanto mais atrai, o link covalente é prolongado.
-As ligações covalentes mais simples existem apenas entre dois átomos ao mesmo tempo e são representados com um script ou linha (-).
Existem outros recursos que se aplicam a links covalentes mais complexos, que também estão em conformidade com o que é comentado acima.
Tipos de links covalentes
As ligações covalentes podem ser classificadas, em princípio, de duas maneiras: de acordo com o número de elétrons compartilhados e de acordo com a polaridade resultante quando a molécula é formada. Ambos serão descritos superficialmente abaixo.
De acordo com o número de elétrons compartilhados
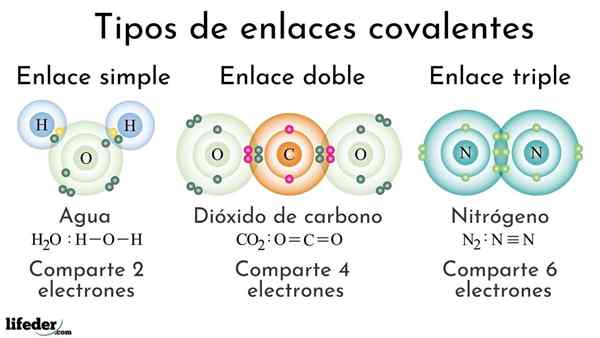 Tipos de ligações covalentes de acordo com o número de elétrons compartilhados
Tipos de ligações covalentes de acordo com o número de elétrons compartilhados Títulos covalentes de acordo com o número de elétrons compartilhados podem ser classificados como simples, duplos ou triplos. Na imagem superior, esses respectivos links para três moléculas que serão discutidos abaixo são mostrados.
-
Simples
A ligação covalente simples é aquela em que existem apenas alguns elétrons, ou seja, dois elétrons. Um exemplo deste link que vemos na molécula de água, h2QUALQUER. Observe que de todas as ligações covalentes, o simples, i-i, é o mais longo de tudo. Isso é quase sempre.
-
Dobro
Na ligação covalente dupla que temos, como o nome indica, dois pares de elétrons, o que significa que existem quatro elétrons que reforçam o "gancho eletrônico" entre os dois átomos vinculados.
Isto é, uma ligação dupla (=) é mais forte que simples (-). No entanto, é mais reativo, o que, embora possa parecer contraditório, é fácil de explicar, considerando a sobreposição de orbitais atômicos.
Pode atendê -lo: polaridade (química): o que é, definição, exemplosUm exemplo deste link é visto na molécula de dióxido de carbono, CO, CO2. Os dois átomos de oxigênio permanecem fortemente unidos ao carbono graças a esse vínculo, OR = C = O, que, por serem mais fortes, mais próximos dos átomos; E por sua vez, isso leva ao link a ser reduzido.
-
Triplo
O link triplo é o mais forte e mais curto das ligações covalentes (comum). Observe que para a molécula de nitrogênio, n2 ou n 3., seus átomos representados por esferas azulados estão muito próximos.
No link triplo, temos três pares de elétrons, o que é igual a seis elétrons que reforçam a ligação covalente entre os dois átomos.
-
Dativo
O link dativo é um tipo especial de link simples que consiste no par de elétrons vem apenas de um dos dois átomos vinculados. Isto é, pode ser visto como um "compartilhamento forçado".
Por exemplo, a molécula M2Ou use um dos pares sem oxigênio para doá -los para um íon h+ (H2O: → H+ = [H2OH]+ ou h3QUALQUER+).
De acordo com a polaridade
As ligações covalentes de acordo com a polaridade podem ser classificadas como covalentes polares ou covalentes não polares.
-
Ligações covalentes polares
Ocorre entre dois átomos diferentes cuja diferença de eletronegatividade é grande. Isso resulta na formação de um dipolo, onde um átomo se concentra negativamente (atrai elétrons), enquanto o outro concentrado positivamente (produz elétrons). Por exemplo, a ligação covalente HF (H-F) é polar, porque o fluoreto é mais eletronegativo que o hidrogênio.
-
Links covalentes não polares
Ocorre entre dois átomos idênticos cuja diferença na eletronegatividade é zero ou muito pequena. As moléculas mencionadas acima: eu2, QUALQUER2 e n2 Eles apresentam ligações covalentes não polares. Portanto, os elétrons estão em torno dos dois átomos com a mesma frequência.
Pode atendê -lo: uretano: estrutura, propriedades, obtenção, usosExemplos de links covalentes
Finalmente, outros títulos covalentes serão listados além dos já explicados, indicando também seus tipos:
H2S (H-S-H), simples covalente polar | HCl (H-Cl), link covalente simples polar |
H2 (H-H), não polar simples covalente | C2H4 (H-C≡C-H), com dois links polares simples (C-H) e um link triplo não polar (C≡C) |
F2 (F-F), covalente não polar simples | P2 (p≡P), vínculo covalente não polar (ou apolar) |
Co₂ (o = c = o), covalente polar dupla | S2 (s = s), ligação covalente dupla não polar |
HCN (H-C≡N), com uma ligação covalente polar simples (H-C) e outro link polar triplo (c≡N) | NH3 (N-H), com três ligações covalentes polares simples |
Os exemplos citados correspondem a pequenas moléculas. Mas as ligações covalentes estão presentes em todas as moléculas existentes, incluindo polímeros, biomoléculas, macromoléculas, minerais, cerâmica, hidrocarbonetos, entre muitos outros.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- María Estela Raffino. (28 de junho de 2020). Ligação covalente. Conceito.de. Recuperado de: conceito.de
- Wikipedia. (2020). Ligação covalente. Recuperado de: em.Wikipedia.org
- Camy Fung e Nima Mirzaee. (15 de agosto de 2020). Ligações covalentes. Química Librettexts. Recuperado de: química.Librettexts.org
- Helmestine, Anne Marie, Ph.D. (27 de agosto de 2020). O que é um vínculo covalente na química? Recuperado de: pensamento.com

