Unidades de energia livre de Gibbs, como é calculado, exercícios resolvidos

- 1577
- 457
- Alfred Kub
O Energia livre de Gibbs (comumente chamado G) é um potencial termodinâmico definido como a diferença na entalpia H, exceto o produto da temperatura t, pela entropia S do sistema:
G = h - t s
A Gibbs Free Energy é medida em Joules (de acordo com o sistema internacional), em Ergios (para o Sistema de Unidades da Liga), em Calorias ou Electron Volts (Para electro volts).
 figura 1. Diagrama mostrando a definição de energia Gibbs e seu relacionamento com os outros potenciais termodinâmicos. Fonte: potência nuclear.líquido.
figura 1. Diagrama mostrando a definição de energia Gibbs e seu relacionamento com os outros potenciais termodinâmicos. Fonte: potência nuclear.líquido. Nos processos que ocorrem a pressão e temperatura constantes, a variação da energia livre de Gibbs é ΔG = ΔH - T ΔS. Em tais processos, (g) representa a energia disponível no sistema que pode se tornar trabalho.
Por exemplo, em reações químicas exotérmicas, a entalpia diminui enquanto a entropia aumenta. No Gibbs, funcionam, esses dois fatores são neutralizados, mas somente quando a energia de Gibbs diminui a reação ocorre espontaneamente.
Portanto, se a variação de g é negativa, o processo é espontâneo. Quando a função Gibbs atinge seu mínimo, o sistema atinge um equilíbrio estável. Em resumo, em um processo para o qual a pressão e a temperatura permanecem constantes, podemos afirmar:
- Se o processo for espontâneo, então ΔG < 0
- Quando o sistema está em equilíbrio: ΔG = 0
- Em um processo não espontâneo, aumenta: ΔG> 0.
[TOC]
Como é calculado?
A energia livre de Gibbs (G) é calculada pela definição dada no início:
G = h - t⋅s
Por sua vez, a entalpia H é um potencial termodinâmico definido como:
H = u + P V
- Passo a passo
Em seguida, será feita uma análise de etapa -para conhecer as variáveis independentes das quais a energia Gibbs é uma função:
1- Da primeira lei da termodinâmica, a energia interna está relacionada à entropia do sistema e seu volume V para processos reversíveis por meio do relacionamento diferencial:
Pode servir a você: brometo de etídio: estrutura, propriedades, usos, toxicidadeDU = DQ - DW = TDS - PDV
A partir desta equação, segue -se que a energia interna u é uma função das variáveis S e V:
U = u (s, v)
2- A partir da definição de H e a tomada do diferencial: é obtido:
dh = du + d (p v) = du + vdp + pdv
3- Substituindo a expressão por DU obtida em (1) você deve::
Dh = tds - pdv + vdp + pdv = tds + vdp
A partir daqui, conclui -se que a entalpia H depende da entropia S e da pressão P, ou seja::
H = h (s, p)
4- Agora é calculado o diferencial total de energia livre de Gibbs: obtendo:
Dg = dh -tds -sdt = tds + vdp -tds -sdt
Onde DH foi substituído pela expressão encontrada em (3).
5- Finalmente, simplificando, você recebe: DG = VDP - SDT, É claro que a energia livre g depende da pressão e da temperatura T como:
G = g (p, t)
- Relacionamentos termodinâmicos de Maxwell
A partir da análise na seção anterior, segue -se que a energia interna de um sistema é uma função de entropia e volume:
U = u (s, v)
Então o diferencial de OU ser:
du = ∂SU |V Ds + ∂VU |S DV = TDS - PDV
A partir dessa expressão em derivados parciais, as relações termodinâmicas de maxwell e assim portadas podem ser deduzidas. Os derivados parciais se aplicam quando uma função depende de mais de uma variável e é facilmente calculada aplicando o teorema da seção a seguir.
O primeiro relacionamento de Maxwell
∂VT |S = -MonSP |V
Para chegar a este relacionamento, o Teorema da Clairaut - Schwarz em derivados parciais, que afirma o seguinte:
"A segunda ordem derivados misturados com as variáveis trocadas são as mesmas, desde que as funções a serem derivadas sejam contínuas e diferenciáveis".
Segundo relacionamento de Maxwell
A partir do que foi demonstrado no ponto 3 da seção anterior:
Pode atendê -lo: fatores que afetam a solubilidadeH = h (s, p) e dh = tds + vdp
Pode ser obtido:
∂PT |S = ∂SV |P
Prosseguir de uma maneira semelhante com a Gibbs Free Energy G = g (p, t) E com a energia livre de Helmholtz F = f (t, v) Para obter as outras duas relações termodinâmicas de Maxwell.
 Figura 2. Josiah Gibbs (1839-1903) foi um físico, químico e matemático americano que fez grandes contribuições para a termodinâmica. Fonte: Wikimedia Commons.
Figura 2. Josiah Gibbs (1839-1903) foi um físico, químico e matemático americano que fez grandes contribuições para a termodinâmica. Fonte: Wikimedia Commons. Os quatro relacionamentos termodinâmicos de Maxwell
1- associado à energia interna u: ∂VT |S = -MonSP |V
2- aquele obtido da entalpia H: ∂PT |S = ∂SV |P
3- Relacionado à energia de Helmholtz F: ∂TP |V = ∂VS |T
4- ligado à energia livre de Gibbs G: ∂TV |P = -MonPS |T
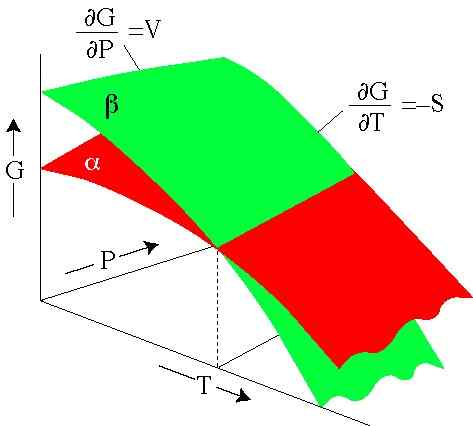 Figura 2. A energia de Gibbs depende da pressão e temperatura. Cada superfície representa uma fase. (Serc.Carleton.Edu)
Figura 2. A energia de Gibbs depende da pressão e temperatura. Cada superfície representa uma fase. (Serc.Carleton.Edu) Exercícios resolvidos
Exercício 1
Calcule a variação da energia livre de Gibbs para 2 moles de gás ideal a uma temperatura de 300k durante uma expansão isotérmica que leva ao sistema de volume inicial de 20 litros a um volume final de 40 litros.
Solução
Lembrar a definição de energia livre de Gibbs é:
G = h - t s
Então uma variação finita de F será:
ΔG = ΔH - T ΔS, Desde Δt = 0
Em gases ideais, a entalpia depende apenas de sua temperatura absoluta, mas como é um processo isotérmico, então ΔH = 0 e ΔG = - T ΔS.
Para gases ideais, a variação de entropia de um processo isotérmico é:
ΔS = nr ln (V2/V1)
Que se aplica ao caso deste exercício que temos:
ΔS = 2 moles x 8.314 j/(k mol) x ln (40l/20l) = 11,53 j/k
Então podemos obter a mudança na energia de Helmholtz:
ΔG = - 300k x 11,53 J/k = -3457,70 j.
Exercício 2
Levando em consideração que a energia livre de Gibbs é uma função da temperatura e pressão g = g (t, p); Determine a variação de g durante um processo em que a temperatura não muda (isotérmica) para n moles de um gás monoatômico ideal.
Pode atendê -lo: hidróxido de estrôncio (sr (oh) ₂)Solução
Como demonstrado acima, a mudança na energia de Gibbs depende apenas da mudança de temperatura t e do volume V; portanto, uma variação infinitesimal é calculada de acordo com:
DG = -SDT + VDP
Mas se for um processo em que a temperatura é constante, df = + VDP, portanto, uma variação finita da pressão ΔP leva a uma mudança na energia de Gibbs dada por:
ΔG = + ∫ vdp = + ∫ (n r t) dp/p = + n r t ln (Δp)
Usando a equação de gás ideal:
P V = n r t
Durante um processo isotérmico, acontece que:
D (P V) = P dv + V dp = 0
Quer dizer que:
dp/p = - dv/v
Portanto, o resultado anterior pode ser escrito dependendo da variação de volume ΔV:
Δg = + ∫ vdp = + ∫ (n r t) dp/p = - ∫ (n r t) dv/v = -n r t ln (ΔV)
Exercício 3
Considerando a seguinte reação química:
N20 (g) + (3/2) ou2 (g) ↔️no2 (g) à temperatura t = 298 K
Encontre a variação da energia livre de Gibbs e, através do resultado obtido, indique se é ou não um processo espontâneo.
Solução
Abaixo das etapas:
- Primeiro passo: entalpias de reação
ΔHR = 2*ΔH (NO2 (g)) - ΔH (n20 (g)) = 2*33.2-81.6 = -15.2kj/mol
- Segundo passo: a variação de entropia da reação
ΔSR = 2*s (não2 (g)) - s (n20 (g)) - (3/2) s (ou2 (g)) = 2*240.1 - 220.1 - 1,5*205.2 = -47,7 J/(mol*k).
- Terceira etapa: variação na função Gibbs
Este valor determinará o equilíbrio entre a diminuição da energia e o aumento da entropia para saber se a reação é finalmente espontânea ou não.
Δgr = Δhr -t ΔSr = -15,2 -298*(-47,7) = -985,4 j/mol
Como é uma variação negativa da energia de Gibbs, pode -se concluir que é uma reação espontânea à temperatura de 298 K = 25 ºC.
Referências
- Castaños e. Exercícios de energia livre. Recuperado de: Lidiaconlachimica.WordPress.com.
- Cengel, e. 2012. Termodinâmica. 7ª edição. McGraw Hill.
- Librettexts. Energia livre de Gibbs. Recuperado de: química.Librettexts.org
- Librettexts. O que são energia livre. Recuperado de: química.Librettexts.org
- Wikipedia. Energia livre de Gibbs. Recuperado de: é.Wikipedia.com
- Wikipedia. Energia livre de Gibbs. Recuperado de: em.Wikipedia.com
- « Fundamentos do método Mohr, reações, procedimento, usa
- Conceito e caracterização de sistemas cristalinos, tipos, exemplos »

