Energia interna

- 1267
- 158
- Dennis Heidenreich
Explicamos o que é energia interna, sua função, como calculá -la e dar vários exemplos
 Diagrama mostrando contribuições para a energia interna de um sistema. Fonte: f. Zapata
Diagrama mostrando contribuições para a energia interna de um sistema. Fonte: f. Zapata O que é energia interna?
O energia interna De um objeto vem do movimento aleatório que os átomos e moléculas que o compõem têm. Mesmo quando o objeto está perfeitamente em repouso, dentro, no nível microscópico, as partículas que o compõem se movem continuamente sem descanso.
Como essas partículas estão se movendo, elas têm energia cinética, o que faz parte de sua energia interna. A outra contribuição para a energia interna é a energia potencial que vem de forças intermoleculares, responsável por manter a coesão da substância.
Essas forças intermoleculares são geralmente de origem eletromagnética, mas as forças gravitacionais e nucleares também participam.
Agora, dependendo do tipo de movimento de partículas, a energia cinética pode ser:
- Translacional
- Vibracional
- Rotação
A temperatura mede apenas a energia cinética translacional das partículas. Em princípio, a maior temperatura, a energia interna será maior, mas isso também depende da massa. A exemplo A questão esclarece: um copo com água morna tem menos energia interna do que um lago à temperatura ambiente, embora a temperatura do vidro seja maior, e isso é porque há mais água no lago do que no vidro.
De qualquer forma, a energia interna de uma substância não é perceptível em vista, não depende de seu movimento, nem depende de sua posição relativa em relação a outros objetos. Por exemplo, a energia interna de um vidro com água à temperatura ambiente é a mesma se o vidro estiver em uma mesa ou se estiver no chão.
Pode atendê -lo: vetores não -coplanares: definição, condições, exercíciosFunção de energia interna
Energia interna, que geralmente é indicada como U, é uma função que depende das variáveis termodinâmicas do sistema, como a temperatura t e o volume V. Portanto, pode ser expresso matematicamente como:
U = u (t, v)
Na realidade, o valor absoluto da energia interna de um sistema não é relevante, o que importa é sua variação, que é indicada com a letra grega δ ("delta"):
ΔU = u inicial - OU final
Agora, a energia interna pode ser variada se o calor for adicionado ou extraído. Adicionando calor É possível que o sistema faça um determinado trabalho, como um pistão no cilindro de um motor.
A primeira lei da termodinâmica
Desde a primeira lei da termodinâmica, é estabelecido que A variação da energia interna De um sistema equivalente a:
ΔU = Q - W
Onde qual é a quantidade de calor transferida para o sistema e w é o trabalho que o sistema faz, caso execute alguns. Tudo é medido em Joules no sistema internacional de unidades.
Se o sistema não funcionar, o calor fornecido será usado em sua totalidade para aumentar a energia interna do sistema.
O seguinte segue da expressão anterior:
- Δu> 0 significa que o sistema aumenta sua energia interna
- ΔU < 0 la energía interna del sistema disminuye
- Q> 0 O sistema absorve calor
- W> 0 o sistema funciona.
Como calcular a energia interna?
O gás ideal monoatômico
No modelo de gás ideal monoatômico (um único átomo), as partículas não interagem entre si, de modo que a energia cinética translacional é a única contribuição para a energia interna ou o gás. Há um teorema, chamado Teorema da equivalência, que afirma que cada grau de liberdade tem uma energia igual a:
Pode atendê -lo: difração de ondas: conceito e exemplosOnde t é a temperatura e r é a constante dos gases ideais, cujo valor nas unidades do sistema internacional é:
8.314472 J/mol ∙ K
Um grau de liberdade representa a possibilidade de se mover por uma certa direção no espaço. Uma partícula de gás ideal pode se mover nas três direções do espaço; portanto, a energia de n moles de gás é:
Quantidade de calor
Supondo que o calor seja adicionado a um sistema e isso não funciona, esse calor é usado apenas para aumentar a energia interna do sistema. A quantidade de calor que deve ser proporcional à massa m do sistema e a mudança de temperatura:
Q ∝ m⋅Δt
A constante de proporcionalidade depende da substância e é chamada calor específico. Chamando C para esta constante, o calor é:
Q = Mc⋅ΔT
À medida que o calor é revertido no aumento da energia interna:
Q = mc⋅Δt = ΔU
Δu corresponde a a variação Em energia interna.
Exemplos de energia interna
1. Variações de temperatura
Mudanças na temperatura das substâncias, por sua vez, geram mudanças em sua energia interna. É isso que acontece, por exemplo, ao cozinhar. Ao aquecer os alimentos, a agitação de suas moléculas aumenta, a energia cinética aumenta e, portanto, faz sua energia interna.
2. Energia interna de duas substâncias na mesma temperatura
Duas substâncias na mesma temperatura não têm necessariamente a mesma energia interna, pois depende de duas contribuições: energia cinética e energia potencial.
Se as substâncias estiverem na mesma temperatura, pode -se afirmar que a energia cinética translacional de suas partículas é a mesma, mas a energia potencial é diferente, pois isso depende da configuração dos átomos constituintes.
Pode servir a você: pressão hidrostática: fórmula, cálculo, exemplos, exercícios3. Expansão térmica
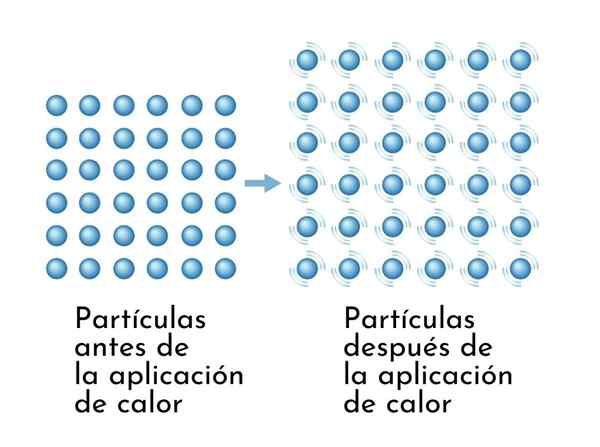 As substâncias se expandem quando aquecidas, uma vez que o aumento da energia interna faz com que suas partículas vibrem mais amplamente, de modo que as dimensões aumentam
As substâncias se expandem quando aquecidas, uma vez que o aumento da energia interna faz com que suas partículas vibrem mais amplamente, de modo que as dimensões aumentam Uma conseqüência visível das substâncias de aquecimento é o aumento de suas dimensões, uma vez que a distância média entre seus átomos aumenta.
As forças intermoleculares podem ser simuladas através de molas que unem átomo.
4. Gases comprimidos
Os gases compactados podem armazenar energia interna, uma vez que sua densidade aumenta diminuindo o volume e, com ela, suas interações com as paredes do recipiente. Dessa forma, um gás compactado é capaz de fazer um trabalho como mover um pistão.
5. Baterias
Em uma bateria, reações químicas ocorrem capaz de gerar uma corrente elétrica assim que o circuito fechar. Essa energia potencial química é considerada como parte da energia interna do sistema.
6. Sistema que absorve calor e funciona
Quando um sistema absorve o calor, aumenta sua energia interna. Mas se, ao mesmo tempo, ele faz um trabalho, a primeira lei da termodinâmica pode ser usada para saber quanta energia interna muda. Por exemplo, assumindo que um sistema absorva 175 j de calor e realiza um trabalho equivalente a 62 J, a mudança em sua energia interna é:
ΔU = q - W = 175 J - 62 J = 113 J.



