Energia de ativação

- 3151
- 942
- Tim Mann
Explicamos qual é a energia de ativação, sua fórmula, unidades, como ela é calculada e damos vários exemplos
O que é energia de ativação?
O energia de ativação (Epara) É definido como a energia mínima necessária para que uma reação química seja realizada. Em outras palavras, é a barreira energética que deve ser superada para que os reagentes possam se tornar produtos.
A energia de ativação pode ser vista em ação na vida cotidiana. De fato, todos sabemos que, ao abrir a chave de passagem do gás na cozinha, ela não queima imediatamente quando entra em contato com o ar.
Para que a reação de combustão começa, é necessário fornecer uma faísca ou o fogo de uma partida em. Esta faísca ou este incêndio representa a energia de ativação da reação de combustão.
Por que uma energia de ativação é necessária?
Para entender a razão pela qual as reações precisam de uma energia mínima para ocorrer, é importante entender, em primeiro lugar, como elas ocorrem. Para dois átomos ou moléculas reagirem, eles devem primeiro colidir. Além disso, eles devem fazê -lo com a orientação certa para que novas ligações químicas possam ser formadas e os idosos possam quebrar.
No entanto, mesmo que as duas moléculas sejam direcionadas uma à outra com a orientação perfeita, isso não garante que uma colisão eficaz seja dada, devido à repulsão entre os elétrons da superfície das moléculas.
Por esse motivo, é necessário que, além de uma orientação correta, as moléculas também viajem com alguma velocidade ou com alguma energia cinética mínima que garante que a colisão seja forte o suficiente para neutralizar a repulsa de elétrons.
Essa energia cinética mínima necessária no nível microscópico é a que se traduz na energia de ativação da reação.
Pode atendê -lo: brometo de lítio: estrutura, propriedades, usos, riscosO que é visto em um diagrama de energia?
Um diagrama de energia é uma representação gráfica que mostra como a energia dos reagentes varia à medida que são transformados em produtos. Nesses diagramas, como o apresentado abaixo, é fácil ver e interpretar energia de ativação.

Neste gráfico, a linha azul mostra a energia à medida que a reação avança. Aqui você pode ver que, para se tornar os produtos, os reagentes devem primeiro superar uma colina para alcançar o estado de transição. Caso contrário, eles serão devolvidos ao seu estado inicial.
A altura desta colina é com precisão energia de ativação. Se for possível superar, o resto da estrada está ladeira abaixo, e os reagentes terminam rapidamente se tornando os produtos.
Unidades de energia de ativação
A energia de ativação é uma magnitude intensiva que é expressa em unidades de energia sobre massa ou toupeiras. Como existem diferentes unidades de energia e unidades de massa diferentes, a energia de ativação pode ser expressa em várias unidades diferentes. No entanto, aqueles usados com mais frequência na química são:
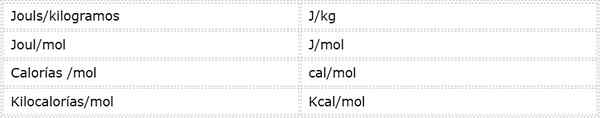
Qual unidade é usada depende dos dados dos quais são calculados ou do uso que será fornecido em outros cálculos.
Fórmula de energia de ativação
A energia de ativação está relacionada à velocidade de reação. De fato, quanto maior a energia de ativação, menor a velocidade. Esse relacionamento é expresso matematicamente através da equação de Arrhenius, que relaciona a constante de velocidade de uma reação à temperatura.
Pode servir a você: Benedict Reagent: para que é isso, componentes, preparação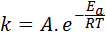
Nesta equação, k É a velocidade constante da reação epara É a energia de ativação, r é a constante dos gases ideais, t é a temperatura absoluta e é chamado de fator pré-exponencial de Arrhenius, também chamado de fator de colisão.
Esta equação pode ser reorganizada para dar:
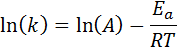
Se o valor de A para a reação for conhecido, a energia de ativação poderá ser obtida limpando a equação anterior. No entanto, não é assim que a energia de ativação de uma reação é geralmente determinada. Normalmente a constante de velocidade é determinada em duas ou mais temperaturas, o que torna desnecessário saber.
Como a energia de ativação é calculada?
A energia de ativação é determinada a partir dos valores da velocidade constante em diferentes temperaturas. Pelo menos dois valores de k medido em diferentes valores t para calcular a energia de ativação sem saber, o que geralmente é o caso.
Dependendo de quantos valores de k Eles têm, você pode calcular epara De duas maneiras:
1. Quando voce tem k em duas temperaturas
Nesses casos, é mais fácil começar a partir da primeira forma da equação de Arrhenius. Se ligarmos k1 para a velocidade constante na temperatura T1 e k2 para a velocidade constante na temperatura T2, Então podemos escrever a equação de Arrhenius duas vezes:
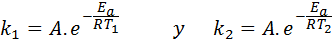
Agora, podemos dividir qualquer uma das duas equações entre a outra para cancelar a:
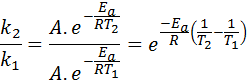
Então, levando o logaritmo neperiano de ambos os lados e resolvendo epara, se obtem:
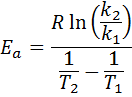
2. Quando voce tem k Mais de duas temperaturas
Nos casos em que existem várias determinações da velocidade constante em várias temperaturas, é preferível encontrar a energia de ativação graficamente ou por meio de regressão linear. Isso é baseado na equação na forma logarítmica, que tem a forma de uma linha:
Pode atendê-lo: Clausius clapeyron Equação: Para que é, exemplos, exercícios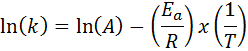
Se fizermos um gráfico de LN (k) versus (1/t), obteremos uma linha reta que corta o eixo e em ln (a) e cuja inclinação é igual a -(epara/R). A partir daí, a energia de ativação é obtida.
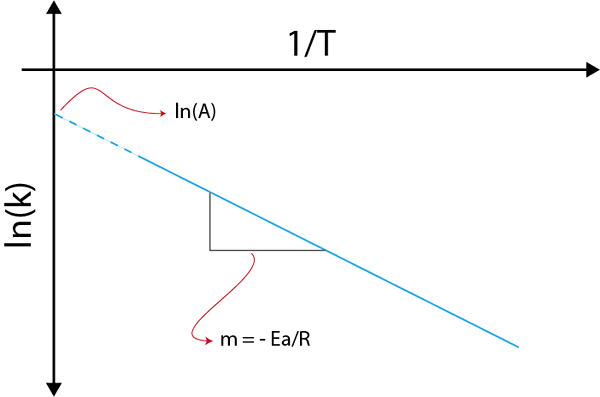 Gráfico de Arrhenius para determinar a energia de ativação
Gráfico de Arrhenius para determinar a energia de ativação Exemplos de cálculo das energias de ativação
Exemplo 1
A constante de velocidade de uma reação de primeira ordem foi determinada em duas temperaturas diferentes. 298 K tinha um valor de 0.058 s-1, enquanto em 350 k o valor aumentou para 0,425 s-1. Determine a energia de ativação dessa reação em J/mol.
- Solução: Como você tem a constante em duas temperaturas, a fórmula de energia de ativação mostrada acima pode ser usada diretamente. Como a energia é solicitada em unidades J/mol, devemos usar a constante de gás nessas unidades:
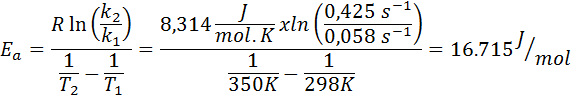
Exemplo 2
Velocidade constante para uma segunda reação química de ordem é medida em diferentes temperaturas. Os valores são apresentados na tabela a seguir. Determine a energia de ativação em kcal/mol.
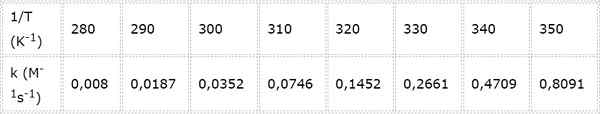
- Solução: Como neste caso existem várias temperaturas, é preferível determinar a energia de ativação graficamente. Para fazer isso, é feito um gráfico de ln (k) vs 1/t, que é apresentado abaixo.
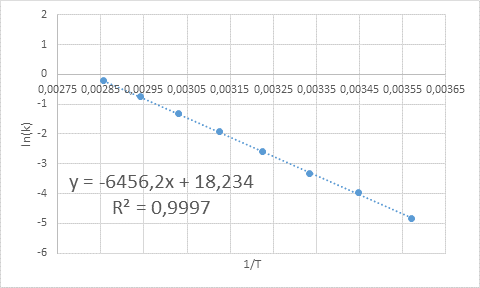 Exemplo de determinação gráfica da energia de ativação
Exemplo de determinação gráfica da energia de ativação A partir da equação da linha mostrada no gráfico, a inclinação é obtida, que é -6456.2. Como a inclinação (m) é igual a - epara/R, então:
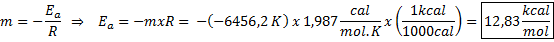
Ou seja, a energia de ativação dessa reação é de 12,83 kcal/mol.

