Elétrons internos

- 2756
- 236
- Terrence King IV
Explicamos o que são elétrons internos, suas características e damos vários exemplos
O que são elétrons internos?
Sempre que pensamos em um átomo, imaginamos um núcleo formado por prótons e nêutrons, cercado pelos elétrons que giram em torno dele, semelhante à maneira como os planetas giram ao redor do sol.
Mas nem todos os elétrons são iguais e duas classes podem ser distinguidas, dependendo de quão perto ou longe elas estão do núcleo atômico.
Alguns estão mais distantes do núcleo e são chamados de elétrons de valência. Estes são responsáveis por todas as reações químicas que conhecemos. Por outro lado, Aqueles que estão mais próximos do núcleo e mais fortemente unidos, são os que chamamos de elétrons internos.
Características de elétrons internos
Eles são os elétrons mais estáveis
Como regra geral, quanto menor o nível de energia de um elétron, isso é mais estável. Os elétrons internos ocupam orbitais nos níveis mais baixos de energia de um átomo, portanto, eles também são os elétrons mais estáveis.
Eles estão mais fortemente unidos ao núcleo
O núcleo atrai elétrons porque ambos têm cargas opostas: o núcleo é positivo enquanto elétrons negativos. Essa força aumenta à medida que a distância diminui.
Como conseqüência disso, os elétrons internos, que são os mais próximos do núcleo, também são os que estão mais fortemente ligados ao mesmo. Por esse mesmo motivo, eles também são os elétrons mais difíceis de remover.
Eles não fazem parte das ligações químicas
Quando um átomo se aproxima de outro, a primeira coisa a tocar é seus elétrons mais externos. Por esse motivo, apenas os elétrons de Valência intervêm em reações químicas. Elétrons internos nem participam de ligações químicas, nem estão envolvidas em nenhuma reação química.
Pode atendê -lo: quantos elétrons de custain carbono tem?Eles são muito protegidos
Isso significa que os elétrons internos estão entre os elétrons externos e o núcleo, criando um tipo de tela que reduz a força com a qual o núcleo atrai os elétrons da valência.
Eles sempre vêm em pares
Em cada orbital, existem apenas dois elétrons com giros opostos, que são chamados de elétrons emparelhados (que é outra maneira de dizer que eles formam um casal). Como os orbitais onde os elétrons internos estão localizados, eles estão sempre completamente cheios, então esses elétrons são sempre emparelhados.
Como sabemos quantos elétrons internos um átomo tem?
Saber quantos elétrons internos tem um átomo é muito simples. Você só precisa saber quantos elétrons o átomo tem e quantos desses elétrons pertencem à camada de Valência. Todos os outros elétrons são elétrons internos.
Mas como descobrimos esses números? Nas seções seguintes, explicamos.
O número total de elétrons é igual ao número atômico
Como os átomos são neutros (ou seja, eles não têm carga elétrica líquida), eles precisam ter o mesmo número de cargas positivas (prótons) como cargas negativas (elétrons). Como o número atômico indica quantos prótons estão no núcleo, também indica quantos elétrons um átomo está por perto quando é neutro.
No caso de íons, que, diferentemente dos átomos têm carga elétrica, o número total de elétrons é obtido subtraindo o número atômico, exceto a carga de íons, com tudo e seu sinal.
Exemplos
- O átomo de carbono (c) é o elemento número 6 da tabela periódica (que é o seu número atômico). Portanto, o átomo de carbono tem 6 elétrons no total.
- O íon de sódio (i) (na+) tem uma carga positiva de +1, e o número atômico de sódio é 11. Portanto, o número total de elétrons deste íon é: 11 - (+1) = 10 elétrons.
- O íon cloreto (CL-) tem uma carga negativa de -1, e o número atômico de cloro é 17. Portanto, o número total de elétrons deste íon é: 17 - ( - 1) = 17 + 1 = 18 elétrons.
O número de elétrons de Valência é igual ao seu grupo na tabela periódica
Os elementos que pertencem ao grupo 1A (os metais alcalinos) têm 1 elétron de Valência. Os pertencentes ao 2º (Alkaliner) têm 2, os do 3º (grupo Boro, alumínio, gálio, etc.) Eles têm 3 e assim por diante. Isso não se aplica a metais de transição.
Como antes, os íons são subtraídos de calcular seus elétrons de valência.
Exemplos
- O oxigênio pertence ao grupo 6A para o que tem 6 elétrons de valência.
- O íon sulfeto (S2-) Também pertence ao Grupo 6A, mas possui uma carga de -2, por isso possui: 6 -( -2) = 6 + 2 = 8 elétrons Valencia.
Exemplos de diferentes átomos e seus elétrons internos
Elétrons de carbono internos (C)

Como vimos um momento atrás, o carbono tem 6 elétrons no total. Além disso, pertence ao Grupo 4A para o que tem 4 elétrons de Valência, por isso tem, no total 6 - 4 = 2 elétrons internos.
Elétrons de nitrogênio interno (n)
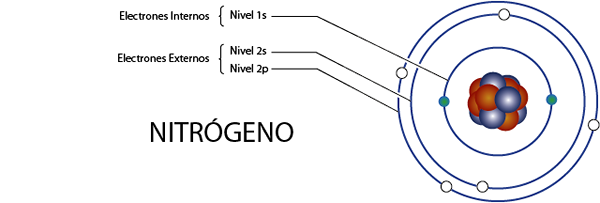
O nitrogênio tem 7 elétrons no total. Além disso, pertence ao Grupo 5A para o que tem 5 elétrons de Valência, por isso tem, no total 7 - 5 = 2 elétrons internos.
Elétrons internos de argônio (AR)
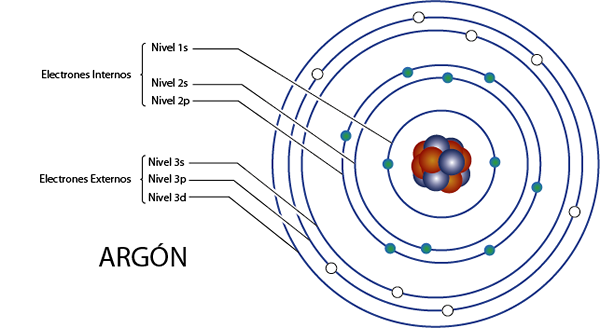
Argônio é elemento 18 para o que tem 18 elétrons no total. Além disso, pertence ao Grupo 8A para o que tem 8 elétrons de Valência, por isso tem, no total 18 - 8 = 10 elétrons internos.
Elétrons internos do íon cloreto (CL-)
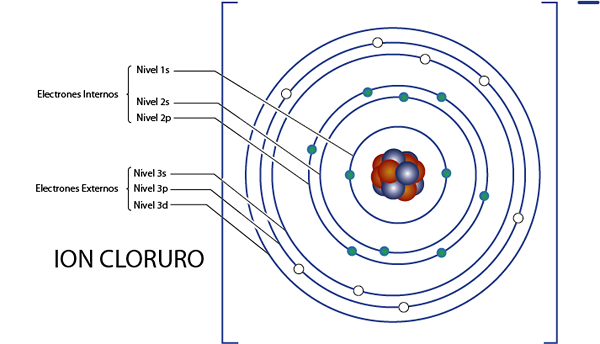
Como vimos um momento atrás, o cloreto tem 18 elétrons no total. Além disso, pertence ao grupo 7A e possui carga -1, por isso possui 7 - ( - 1) = 8 elétrons de valência. Então tem 18 - 8 = 10 elétrons internos, Como o argônio.
Pode servir a você: Química Nuclear: História, Campo de Estudo, Áreas, AplicaçõesElétrons internos de cálcio +2 de íon (CA2+)
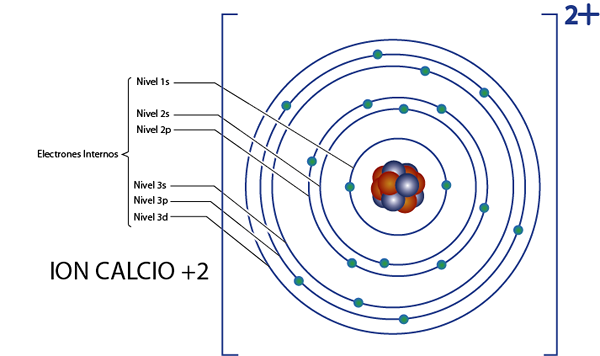
O cálcio é o elemento 20, e este íon tem 2 cargas positivas, por isso possui um total de 20 - 2 = 18 elétrons ao redor do núcleo. Este elemento pertence ao grupo 2A e, como sua carga é +2, não possui elétrons de valência (2 - 2 = 0). Por esse motivo, todos os 18 elétrons deixados pelo cálcio são os que eram originalmente os elétrons internos.
Existem dois elementos que não têm elétrons internos
Os dois elementos mais leves da tabela periódica, que são hidrogênio (H) e hélio (He), têm apenas 1 e 2 elétrons, respectivamente. Ambos os elétrons estão no único nível de energia que esses átomos têm, que é o nível 1.
Por esse motivo, esses elétrons correspondem aos elétrons de valência desses dois elementos. Como não há níveis mais baixos de energia, também não há elétrons internos.

