Eletro-negatividade
- 779
- 164
- Conrad Schmidt
O que é eletronegatividade?
O Eletro-negatividade É uma propriedade periódica relativa que diz respeito à capacidade de um átomo de atrair a densidade eletrônica de seu ambiente molecular. Esta é a tendência de um átomo para atrair elétrons para si mesmo quando está preso a uma molécula. Isso se reflete no comportamento de muitos compostos e em como intermolecularmente interagem entre si.
Em outras palavras, quanto mais eletronegativo é um átomo, maior a capacidade de atrair elétrons de outros átomos; Ele também terá um maior potencial de ionização, o que permite manter seus elétrons diante da atração externa enquanto atrai elétrons dos átomos circundantes.
Agora, nem todos os elementos atraem elétrons de átomos adjacentes no mesmo grau. No caso daqueles que produzem densidade eletrônica, diz -se que eles são Eletropositivo, Enquanto aqueles que "cobrem" elétrons são Eletronegativos. Existem muitas maneiras de explicar e observar esta propriedade (ou conceito).
Por exemplo, nos mapas de potenciais eletrostáticos para uma molécula (como o dióxido de cloro da imagem superior, CLO2) O efeito das diferentes eletronegatividades para átomos de cloro e oxigênio é observado.
A cor vermelha indica as regiões ricas em elétrons da molécula, Δ- e a cor azul que são pobres de elétrons, δ+. Assim, após uma série de cálculos computacionais, esse tipo de mapas pode ser estabelecido; Muitos deles mostram uma relação direta entre a localização dos átomos eletronegativos e δ-.
Também pode ser visualizado da seguinte forma: dentro de uma molécula, é mais provável que o trânsito de elétrons ocorra nas proximidades dos átomos mais eletronegativos.
É por esse motivo que para o CLO2 Os átomos de oxigênio (esferas vermelhas) são cercadas por uma nuvem vermelha, enquanto o átomo de cloro (a esfera verde) de uma nuvem azulada.
A definição de eletronegatividade depende da abordagem dada ao fenômeno, existem várias escalas que a consideram de vários aspectos. No entanto, todas as escalas têm em comum que são apoiadas pela natureza intrínseca dos átomos.
Escalas de eletronegatividade
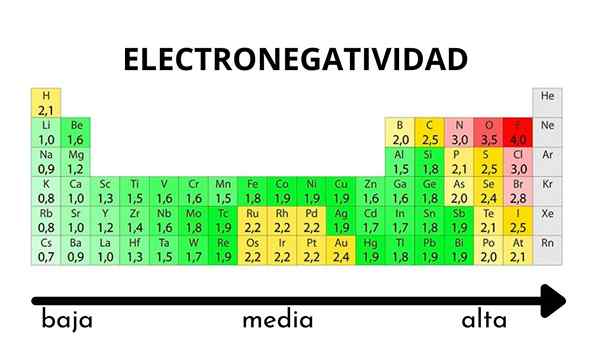
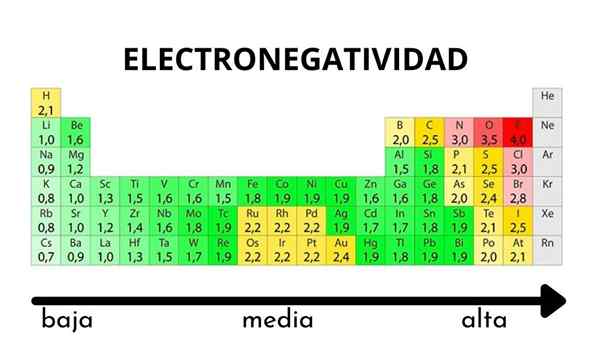 Na tabela periódica, pode ser observado quando o valor da eletronegatividade aumenta ou diminui
Na tabela periódica, pode ser observado quando o valor da eletronegatividade aumenta ou diminui Eletronegatividade não é uma propriedade que pode ser quantificada nem tem valores absolutos. Isso ocorre porque a tendência de um átomo de atrair densidade eletrônica em relação a ele não é a mesma em todos os compostos. Em outras palavras: a eletronegatividade varia dependendo da molécula.
Se para a molécula clo2 O átomo de CL será alterado para N, então a tendência da OR de atrair os elétrons também seria modificada; Pode ser aumentado (obtenha a nuvem vermelha) ou diminuir (perder a cor). A diferença estaria no novo link N-O formado, para ter a molécula O-N-O (dióxido de nitrogênio, não2).
Pode atendê -lo: relacionamento de química e tecnologia com ser humano, saúde e meio ambienteComo a eletronegatividade de um átomo não é a mesma para todos os seus ambientes moleculares, é necessário defini -lo de acordo com outras variáveis. Dessa maneira, existem valores que servem como referência e que permitem prever, por exemplo, o tipo de link formado (iônico ou covalente).
Pauling Scale
O grande cientista e vencedor do Two Nobel Awards, Linus Pauling (1901-1994), criado em 1932, uma forma quantitativa (mensurável) de eletronegatividade, conhecida como escala de Pauling. Nele, a eletronegatividade de dois elementos, A e B, formando links, estava relacionada à energia extra associada ao caráter iônico do link A-B.
Teoricamente, as ligações covalentes são as mais estáveis, uma vez que a distribuição de seus elétrons entre dois átomos é equitativa; isto é, para as moléculas A-A e B-B, ambos os átomos compartilham os elétrons de ligação da mesma maneira. No entanto, se A for mais eletronegativo, então o par de referidos será mais do que de B.
Nesse caso, o A-B não é mais completamente covalente, embora se suas eletronegatividades não diferirem muito, pode-se dizer que seu link tem um caráter covalente alto. Quando isso ocorre, o link passa por pequenas instabilidade e adquire energia extra como produto da diferença de eletronegatividade entre A e B.
Quanto maior essa diferença é, mais a energia do link A-B e, consequentemente, maior o caráter iônico do referido link.
Essa escala representa a mais usada na química, e os valores das eletronegatividades emergiram da alocação de um valor de 4 para o átomo de flúor (o elemento com a eletronegatividade mais baixa é cessium, com 0,7). A partir daí, eles poderiam calcular o dos outros elementos.
Escala Mulliken
Embora a escala de Pauling tenha a ver com a energia associada aos links, a escala Robert Mulliken (1896-1986) está mais relacionada a outras duas propriedades periódicas: energia de ionização (EI) e afinidade eletrônica (AE).
Assim, um elemento com altos valores de EI e AE é muito eletronegativo e, portanto, atrairá elétrons de seu ambiente molecular.
Porque? Porque reflete o quão difícil é "começar" um elétron externo e quão estável o ânion formado em uma fase gasosa é tão estável. Se ambas as propriedades tiverem altas magnitudes, o elemento é "amante" de elétrons.
Pode servir você: fusãoA eletronegatividade de Mulliken é calculada com a seguinte fórmula:
ΧM = ½ (ei + ae)
Isto é, χM É igual ao valor médio de EI e AE.
No entanto, diferentemente da escala de Pauling que depende do que os átomos formam, isso está relacionado às propriedades do estado de Valência (com suas configurações eletrônicas mais estáveis).
Ambas as escalas geram valores semelhantes de eletronegatividade para os elementos e se relacionam aproximadamente à seguinte conversão:
ΧP = 1.35 (χM)1/2 - 1.37
Ambos xM como xP São valores sem dimensão; isto é, eles não têm unidades.
Escala de a.eu. Allred e e. Rochow
Existem outras escalas de eletronegatividade, como Sanderson e Allen. No entanto, o que segue os dois primeiros é a escala Allred e Rchows (χAr). Esta escala é baseada na carga nuclear eficaz que um elétron experimenta na superfície dos átomos. Portanto, está diretamente relacionado à força atraente do núcleo e ao efeito da tela.
Como varia a eletronegatividade na tabela periódica?
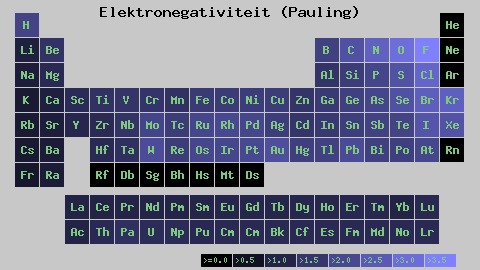 Escala de eletronegatividade de Pauling. Fonte: Wikimedia Commons
Escala de eletronegatividade de Pauling. Fonte: Wikimedia Commons Independentemente das escalas ou valores que possui, a eletronegatividade aumenta da direita para a esquerda por um período e de baixo para cima nos grupos. Assim, aumenta em direção à diagonal superior direita (sem contar o hélio) até que a fluora esteja.
Na imagem superior, os recém -ditos. Na tabela periódica, Pauling Eletronegatividades é expresso de acordo com as cores das caixas. Como o fluoreto é o mais eletronegativo, cabe a ele uma cor roxa mais áspera, enquanto as cores menos eletronegativas (ou eletropositivas).
Também pode ser visto que as cabeças do grupo (H, Be, B, C, etc.) Eles têm as cores mais claras e, à medida que o grupo é descendente pelos outros elementos. O que é isso? A resposta está novamente nas propriedades EI, AE, ZEF (carga nuclear eficaz) e no raio atômico.
O átomo na molécula
Os átomos individuais têm um Z nuclear real e elétrons externos sofrem um produto eficaz de carga nuclear do efeito de blindagem.
À medida que se move durante um período, o Zef aumenta de tal maneira que o átomo é contraído; isto é, os rádios atômicos são reduzidos ao longo de um período.
Isso resulta nisso, no momento da ligação de um átomo a outro, os elétrons "fluirão" para o átomo com maior Zef. Além disso, isso dá um caráter iônico ao link se houver uma tendência acentuada de elétrons para ir a um átomo. Quando não, se fala de um vínculo predominantemente covalente.
Pode atendê -lo: Violet GlassPor esse motivo, a eletronegatividade varia de acordo com os rádios atômicos, Zef, que por sua vez estão intimamente relacionados a EI e AE. Tudo é uma corrente.
Utilidade da eletronegatividade
A eletronegatividade serve, em princípio, para determinar se um composto binário é covalente ou iônico. Quando a diferença de eletronegatividade é muito alta (à taxa de 1.7 unidades ou mais) Dizem que o composto é iônico.
Também é útil discernir em uma estrutura que as regiões possivelmente serão mais ricas em elétrons.
Daqui, pode -se prever qual mecanismo ou reação pode sofrer o composto. Em regiões pobres de elétrons, Δ+, é possível que espécies carregadas negativamente obtidas de uma certa maneira; E nas regiões ricas em elétrons, seus átomos podem interagir de maneiras muito específicas com outras moléculas (interações dipolo-dipolo).
Exemplos (cloro, oxigênio, sódio, fluoreto)
Quais são os valores de eletronegatividade para cloro, oxigênio, sódio e átomos de flúor? Depois do fluoreto, quem é o mais eletronegativo? Usando a tabela periódica, observa -se que o sódio tem uma cor roxa escura, enquanto as cores e o cloro de oxigênio são visualmente muito semelhantes.
Suas eletronegatividades valores para as escalas de Pauling, Mulliken e Allred-RHOW são:
Na (0.93, 1.21, 1.01).
Ou (3.44, 3.22, 3.cinquenta).
Cl (3.16, 3.54, 2.83).
F (3.98, 4.43, 4.10).
Observe que, com valores numéricos, há uma diferença entre as negatividades de oxigênio e cloro.
De acordo com a escala Mulliken, o cloro é mais eletronegativo que o oxigênio, ao contrário de Pauling e Allred-RHochow Scales. A diferença na eletronegatividade entre os dois elementos é ainda mais evidente usando a escala Allred-RHOW. E, finalmente, o fluoreto, independentemente da escala escolhida, é o mais eletronegativo.
Portanto, onde houver um átomo de f em uma molécula significa que o link terá um caráter iônico alto.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição., p. 30 e 44). Mc Graw Hill.
- Jim Clark. (2000). Eletronegividade. Retirado de: Chemguide.co.Reino Unido
- Anne Marie Helmestine, PH.D. (11 de dezembro de 2017). Definição e exemplo de eletronegatidade. Retirado de: pensamento.com
- Marcos e. Tuckerman. (5 de novembro de 2011). Escala de eletronegatidade. Retirado de: NYU.Edu
- Wikipedia (2018). Eletro-negatividade. Tirado de: é.Wikipedia.org

