Estrutura de dimetilanilina, propriedades, síntese, usa
- 3204
- 318
- Shawn Leffler
O dimetilanilina o dimetilfenilamina é um composto orgânico formado por um anel de benzeno com um grupo amino substituído por dois grupos metila. Sua fórmula química é C8HonzeN.
Também é conhecido como N, N-Dimetilanilina, pois é um derivado de Anylin no qual os hidrogênios do grupo amino são substituídos por dois grupos metila. Isso o torna uma amina terciária.
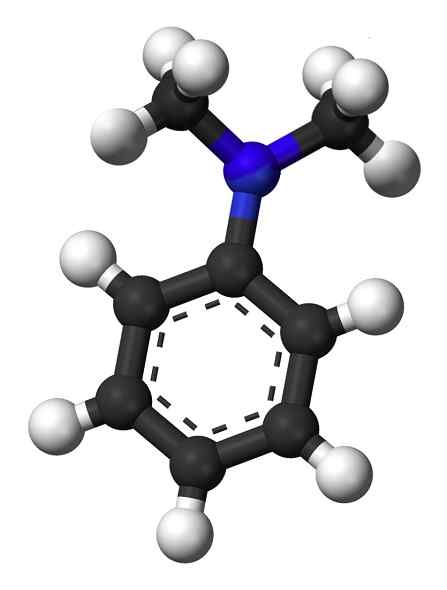
 Estrutura de n, n-dimetilanilina. Nenhum autor legível por máquina fornecido. Mysid assumiu (com base em reivindicações de direitos autorais). [CC BY-SA 3.0 (http: // criativecommons.Org/licenças/BY-SA/3.0/]]. Fonte: Wikipedia Commons.
Estrutura de n, n-dimetilanilina. Nenhum autor legível por máquina fornecido. Mysid assumiu (com base em reivindicações de direitos autorais). [CC BY-SA 3.0 (http: // criativecommons.Org/licenças/BY-SA/3.0/]]. Fonte: Wikipedia Commons. N, n-dimetilanilina é um líquido oleoso amarelo a marrom com o cheiro característico de aminas. É um composto básico e reage com ácido nitroso formando um nitrossocomposto. Quando exposto ao ar, fica marrom.
É usado na fabricação de corantes para pinturas. Também é usado como ativador de catalisadores de polimerização e em misturas usadas para gravação de imagem. Por sua vez, tem sido usado na síntese de compostos antibacterianos ou antibióticos como certos cefalosporinas derivadas da penicilina. N, n-dimetilanilina também é uma base para obter outros compostos químicos.
É um líquido combustível e quando é aquecido até que a decomposição emite vapores tóxicos. A exposição aguda do ser humano ao N, n-dimetilanilina pode levar a efeitos negativos, como dores de cabeça, tontura, diminuição do oxigênio no sangue e coloração azulada da pele, entre outros sintomas.
[TOC]
Estrutura
A figura a seguir mostra a estrutura espacial da n, n-dimetilanilina:
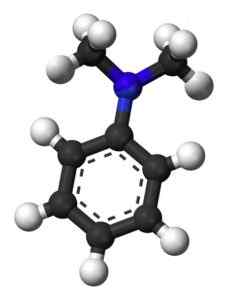 Estrutura espacial de n, n-dimetilanilina. Esquilo [domínio público]. Fonte: Wikipedia Commons.
Estrutura espacial de n, n-dimetilanilina. Esquilo [domínio público]. Fonte: Wikipedia Commons. Nomenclatura
- N, N-Dimetilanilina
- Dimetilanilina
- Dimetilfenilamina
- N, N-Dimetil Bencenamina
N é colocado no nome para indicar que os dois grupos metil (-ch3) estão ligados ao nitrogênio (n) e não ao anel de Benncénico.
Propriedades
Estado físico
Líquido pálido para marrom.
Peso molecular
121,18 g/mol.
Pode atendê -lo: ânion: treinamento, características e tiposPonto de fusão
3 ºC.
Ponto de ebulição
194 ºC.
Ponto de inflamação
63 ºC (método de copo fechado). É a temperatura mínima na qual os vapores podem ser ligados se uma chama for passada.
Pressão de vapor
0,70 mm Hg a 25 ºC.
Temperatura de auto -dirigir
371 ºC. É a temperatura mínima em pressão atmosférica espontaneamente queimada, sem uma fonte externa de calor ou chama.
Densidade
0,9537 g/cm3 A 20 ºC.
Índice de refração
1.5582 a 20 ºC.
Solubilidade
Na água, é muito pouco solúvel: 1.454 mg/L a 25 ºC.
Livremente solúvel em álcool, clorofórmio e éter. Solúvel em acetona, benzeno e solventes oxigenados e clorados.
Constante de basicidade
Kb 11.7, que indica a facilidade com que este composto aceita um íon hidrogênio da água.
Propriedades quimicas
N, n-dimetilanilina é um composto básico. Reage com o ácido acético para dar acetato de n, n-Dimetilanilinio.
O grupo -n (escolha3)2 do n, n-dimetilanilina é um poderoso ativador de substituição aromática na posição para do anel benzeno.
Reage com nitrito de sódio (Nano2) Na presença de ácido clorídrico (HCl) formando p-nitroso-N, n-dimetilanilina. Também com ácido nitroso gera o mesmo nitrosado composto em posição para.
Ao reagir o n, n-dimetilanilina com o cloreto de benzezônio, em um meio ácido suavemente, há um tipo azocomposto ar-n = n-ar ', onde AR é um grupo aromático. As moléculas com grupos azo são compostos fortemente coloridos.
Riscos
Quando aquecido em sua decomposição emite vapores altamente tóxicos de óxidos de nitrogênio nãox.
É um líquido combustível.
Se decompõe lentamente na água exposta à luz solar. Não é biodegradado.
É volatilizado de solo úmido e superfícies de água. Não evapore o solo seco e mova -se através disso. Não se acumula em peixe.
Pode atendê -lo: sulfeto de ferro (ii): propriedades, riscos e usosPode ser absorvido pela pele. Também é rapidamente absorvido pela inalação. A exposição do ser humano a n, n-dimetilanilina pode diminuir o teor de oxigênio do sangue, resultando em uma cor de pele azulada.
A inalação aguda deste composto pode levar a efeitos negativos para o sistema nervoso central e o sistema circulatório, com dores de cabeça, cianose e tontura.
Síntese
Pode ocorrer de várias maneiras:
- De anilina e metanol sob pressão na presença de catalisadores ácidos, como H2SW4. Sulfato é obtido, que se torna a base adicionando hidróxido de sódio.
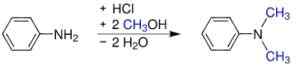 S síntese, n-dimetilanilina. Werderkli - Trabalho próprio. Domínio público. Fonte: Wikipedia Commons.
S síntese, n-dimetilanilina. Werderkli - Trabalho próprio. Domínio público. Fonte: Wikipedia Commons. - Passando um vapor de anilina e éter dimetílico em óxido de alumínio ativado.
- Aquecendo uma mistura de anilina, cloreto de anilínio e metanol sob pressão e depois destilar.
Formulários
Na indústria para colorir
Para a propriedade de reagir com o cloreto de bencenodiazônio formando azocompiestos, a n-dimetilanilina é usada como intermediário na fabricação de colorir.
É matéria -prima na síntese dos corantes da família Metil Violet.
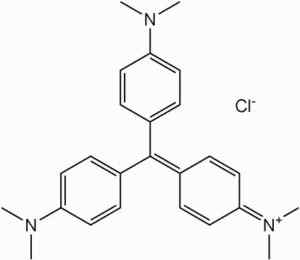 Coloração violeta de metila. Nenhum autor legível por máquina fornecido. Shaddack assumiu (com base em reivindicações de direitos autorais). [Domínio público]. Fonte: Wikipedia Commons
Coloração violeta de metila. Nenhum autor legível por máquina fornecido. Shaddack assumiu (com base em reivindicações de direitos autorais). [Domínio público]. Fonte: Wikipedia Commons Na fabricação de misturas fotocuráveis
A n, n-dimetilanilina faz parte de uma mistura fotocurável que experimenta a reação de cura como resultado de alta sensibilidade a luz visível ou infravermelho próximo, para que possa ser usado para gravar imagens ou materiais de fotorrestonização.
N, n-dimetilanilina é um dos componentes da mistura que causa consciência dos comprimentos de onda, de modo que a composição é curada com luz de comprimento de onda de baixa energia.
Pode atendê -lo: derivados de benzenoEstima-se que a função da n, n-dimetilanilina seja provavelmente para suprimir a reação de terminação da polimerização radical causada por oxigênio.
Na fabricação de fibra de vidro
N, N-Dimetilanilina é usada como um apertado catalítico em certas resinas de fibra de vidro.
Na síntese de antibióticos
N, N-Dimetilanilina participa da síntese de cefalosporinas baseadas em penicilinas.
Os sulfóxidos de penicilina são convertidos em cefemas quando aquecidos na presença de catalisadores básicos como N, N-Dimetilanilina.
Essas cefalosporinas exibem atividade antibacteriana contra organismos gram-positivos e gram-negativos, bem como contra estafilococos resistentes à penicilina.
 Antibióticos. Alina Kuppsova. Fonte: Pixabay.
Antibióticos. Alina Kuppsova. Fonte: Pixabay. No entanto, deve-se notar que N, n-dimetilania permanece nesses antibióticos como impureza.
Em reações químicas
N, N-Dimetilanilina é usada na ativação de catalisadores de polimerização de olefina.
É usado junto com pentafluorofenol (c6F5Oh) com o qual forma o composto iônico [hnphme2]+[H (OC6F5)2]-. Este composto iônico tem um ou dois prótons ativos que ativam o catalisador baseado em um metal de transição.
Além disso, na fabricação de resinas, a n-dimetilanilina tem sido usada como acelerador de polimerização ou promotor para resinas de poliéster. Sua ação gera uma rápida cura da resina.
Em várias aplicações
É usado na síntese de outros compostos químicos, por exemplo, vanilina e como intermediário para medicamentos farmacêuticos.
Também é usado como solvente, como agente alquilante, como estabilizador e para fabricar pinturas e revestimentos.
Referências
- S. Biblioteca Nacional de Medicina. (2019). N, N-Dimetilanilina. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Morrison, r.T. e boyd, r.N. (2002). Química orgânica. 6ª edição. Prentice-Hall.
- (2000). N, N-Dimetilanilina. Resumo. Recuperado da EPA.Gov
- Zanaboni, p. (1966). Composição resinosa de poliéster insaturada tem estabilidade e cura rápida a baixas temperaturas usando uma mistura de dimetilanil, trenanolamina e difenilamina. OU.S. Patente no. 3.236.915. 22 de fevereiro de 1966.
- Nudelman, a. e McCaully, r.J. (1977). Processo para o rearranjo de penicilinas para cefalosporinas e compuções intermediárias. OU.S. Patente no. 4.010.156. 1 de março de 1977.
- Kouji Inaishi (2001). Composição fotocurável. OU.S. Patente no. 6.171.759 B1. 9 de janeiro de 2001.
- Luo, l. et al. (2012). Ácido iônico de bransted. OU.S. Patente no. 8.088.952 B2. 3 de janeiro de 2012.

