Estrutura de dimetilamina ((CH3) 2NH), propriedades, usos, riscos
- 2260
- 493
- Ralph Kohler
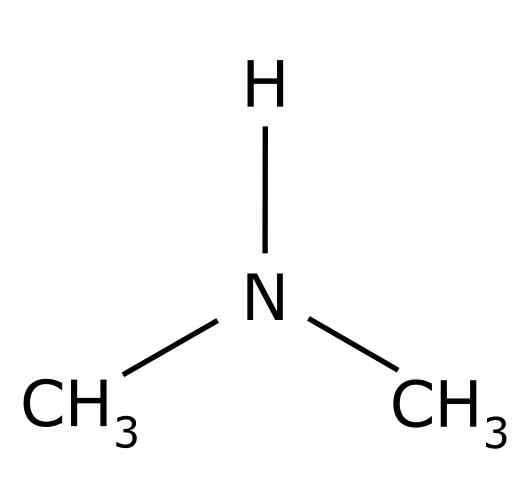
O dimetilamina É um composto orgânico formado por dois grupos metila -Ch3 Unido para um grupo -NH. Sua fórmula química é (Cho3)2NH. É um gás incolor. Quando um cheiro de peixe é percebido no ar em baixas concentrações. No entanto, se estiver em alta concentração, tem um cheiro de amônia NH3.
Dimetilamina está presente em plantas e animais. Acredita -se que no ser humano vem da decomposição de certas enzimas, mas também da ingestão de alguns alimentos, como peixes. Se o gás dimetilamina se dissolve na água, forma soluções muito alcalinas e corrosivas.
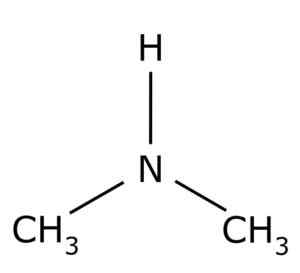 Dimetilamina. Ring0 [domínio público]. Fonte: Wikimedia Commons.
Dimetilamina. Ring0 [domínio público]. Fonte: Wikimedia Commons. Possui vários usos industriais, como produzir solventes, para acelerar a vulcanização da borracha.
Dimetilamina é um gás muito inflamável. Os recipientes que o contêm não devem ser expostos ao aquecimento ou fogo, pois podem explorar. Além disso, seus vapores são olhos irritantes, pele e trato respiratório.
É um composto que pode fazer parte de aerossóis atmosféricos, ou seja, de gotículas muito finas encontradas na atmosfera.
[TOC]
Estrutura
Dimetilamina é uma amina alifática secundária. Isso significa que os substituintes de nitrogênio (n) são alifáticos (-ch3), o que significa que eles não são aromáticos e que são dois. Portanto, existem dois metil -ch3 United Nitrogênio, que também possui hidrogênio (H).
Na molécula de dimetilamina, o nitrogênio (n) possui um par de elétrons livres, ou seja, alguns elétrons que não estão unidos a nenhum outro átomo.
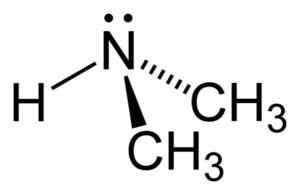 Estrutura da dimetilamina. Autor: Benjah-BMM27. Fonte: Wikimedia Commons.
Estrutura da dimetilamina. Autor: Benjah-BMM27. Fonte: Wikimedia Commons. Nomenclatura
- Dimetilamina
- N, n-dimetilamina
- N-metilmetanamina
- DMA (sigla para di-metil-amina).
Propriedades
Estado físico
Gás incolor.
Peso molecular
45,08 g/mol
Ponto de fusão
-93 ºC
Ponto de ebulição
7.3 ºC
Ponto de inflamação
-6.69 ºC (método de copo fechado).
Temperatura de auto -dirigir
400 ° C
Pode atendê -lo: Lei de Múltiplas ProporçõesDensidade
Líquido = 0,6804 g/cm3 A 0 ºC.
Vapor = 1,6 (densidade relativa em relação ao ar, ar = 1).
Solubilidade
Muito solúvel em água: 163 g/100 g de água a 40 ° C. Solúvel em etanol e éter etílico.
ph
As soluções aquosas de dimetilamina são fortemente alcalinas.
Constante de dissociação
Kb = 5,4 x 10-4
Pkpara de ácido conjugado = 10.732 a 25 ° C. O ácido conjugado é o íon dimetilamônio: (CHO3) NH2+
Propriedades quimicas
Dimetilamina líquida pode atacar alguns plásticos, pneus e revestimentos.
Ao se dissolver na água, o par de elétrons sem nitrogênio (n) leva um próton (H+) de água, deixando um OH grátis-, Por isso, forma soluções muito alcalinas e corrosivas:
Dimetilamina + água → íon dimetilamônio + íon hidroxil
(CH3)2NH + H2O → (escolha3)2NH2+ + Oh-
Com o ácido nítrico, é obtido um sal de nitrato, ou seja, nitrato de dimetila amotilamônio:
Dimetilamina + ácido nítrico → nitrato de dimetilamônio
(CH3)2NH +HNO3 → (cap3)2NH2+NÃO3-
Outras propriedades
Quando em baixa concentração de ar tem um cheiro semelhante ao peixe, enquanto em altas concentrações ele cheira a amônia (NH3).
Reações bioquímicas
No organismo, a dimetilamina pode sofrer nitrilar em condições fracamente ácidas para dar a dimetilnitrosamina um composto de carcinogênio (CH3)2N-no.
A formação de dimetlnitrosamina ocorre a partir de dimetilamina e nitrito (nitrito de sódio) no estômago (um pH 5-6) por ação das bactérias existentes no trato gastrointestinal. O nitrito de sódio está presente em alguns alimentos.
Dimetilamina + nitrito de sódio → dimetilnitrosamina + hidróxido de sódio
(CH3)2NH + Nano2 → (cap3)2N-no + Naoh
Obtenção
A dimetilamina é preparada comercialmente reagindo metanol (escolha3Oh) com amônia (NH3) a 350-450 ° C na presença de um catalisador de sílica alumina (SIO2/Para o2QUALQUER3).
2 cap3Oh + NH3 → (cap3)2NH + 2 h2QUALQUER
Como a monometilamina e a trimetilamina também são produzidas, uma purificação é realizada em uma série de quatro a cinco colunas de destilação.
Presença na natureza
Dimetilamina é encontrada em plantas e animais. Também está presente naturalmente e abundantemente na urina humana.
Pode servir a você: epóxido: nomenclatura, obtenção, aplicações, exemplosEstima -se que sua presença em humanos seja devido ao fato de que certos tipos de bactérias intestinais são produzidas a partir de alguns compostos encontrados em alimentos.
Alguns desses compostos são a colina (composto que está associado ao grupo de vitaminas B) e óxido de trimetilamina. Acredita -se também que ele vem de um inibidor da enzima do óxido nítrico (NO) que é formado no corpo.
Certas fontes de informação indicam que o aumento da dimetilamina na urina é causado pela ingestão de peixes e frutos do mar, onde valores principais são obtidos quando comem lula, pescada, sardinha, peixe -espada, bacalhau, peixe e linha.
 Comer peixes pode aumentar os níveis de dimetilamina na urina. Autor: Anna Sulencha. Fonte: Pixabay.
Comer peixes pode aumentar os níveis de dimetilamina na urina. Autor: Anna Sulencha. Fonte: Pixabay. Pacientes com excesso de dimetilamina
Considera -se que a dimetilamina é uma toxina urêmica, ou seja, uma substância que pode causar danos se sua concentração na urina for aumentada. De fato, foram observados níveis muito altos de dimetilamina em pacientes com doença renal no estágio terminal.
Acredita -se que nesses pacientes pode haver superpopulação de bactérias intestinais que podem estar produzindo.
Formulários
DMA ou DMA é usado para:
- Preparação de outros compostos.
- Produção de solventes de dimetilformamida e dimetilacetamida.
- Acelerar a vulcanização de certas gengivas.
- Elimine cabelos durante o bronzeamento.
- Agir como um antioxidante para solventes.
- Servir como um agente de flutuação mineral.
- Inibir a corrosão e como um agente anti -sniff.
- Função como surfactante.
- Faça sabonetes e detergentes.
- Agir como químico em têxteis.
- Funcionar como um agente antidating em combustíveis e como um estabilizador de gás.
- Prepare corantes.
- Absorver gases ácidos.
- Servir como pesticidas e foguetes.
- Fazer parte de agentes para tratamento de água.
- Atuar como um fungicida em produtos agroquímicos.
- Usos já descontinuados, como atrair e exterminar gorgjos ou insetos que atacam algodão.
 Planta de algodão. Autor: Isaa KC. Fonte: Pixabay.
Planta de algodão. Autor: Isaa KC. Fonte: Pixabay.  No passado, os insetos que atacam plantas de algodão eram eliminados com dimetilamina. Marvinbikolano [CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons.
No passado, os insetos que atacam plantas de algodão eram eliminados com dimetilamina. Marvinbikolano [CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons. Riscos
Os vapores de dimetilamina estão irritando a pele, os olhos e o trato respiratório.
Pode atendê -lo: compostos inorgânicosSe você entrar em contato com a pele em forma líquida, pode causar congelamento e queima química. Sua inalação tem efeitos adversos à saúde.
O gás DMA é corrosivo e pode formar soluções aquosas corrosivas. Suas soluções aquosas podem ficar inflamáveis, a menos que estejam bastante diluídas.
A dimetilamina em forma de gás é facilmente inflamada pela produção de fumos tóxicos de óxidos de nitrogênio (nãox).
Se o recipiente que contém esse gás for exposto a calor ou calor intenso, ele poderá explodir.
Influência do DMA na atmosfera
Aerossol atmosférico (gotículas muito pequenas de mistura de compostos naturais e/ou poluentes na atmosfera) têm um profundo impacto no clima global e na qualidade do ar nas várias regiões do mundo.
A formação de novas partículas de aerossol ainda não está totalmente compreendida.
Estima -se que a dimetilamina participa junto com outros compostos na formação dessas partículas, o que parece depender da área de fortes emissões de DMA.
Por exemplo, nas áreas industriais, há maior concentração do que em áreas agrícolas, e isso pode influenciar a maneira como o DMA participa.
Deve -se notar que, de acordo com alguns cientistas, a queima de material vegetal contendo glifosato (um dos herbicidas mais utilizados no mundo) pode levar à formação de dimetilamina.
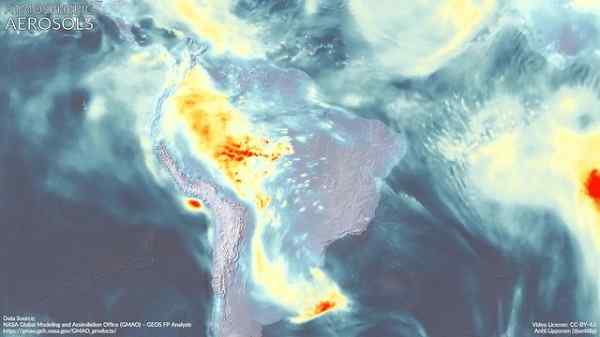 Aerossóis atmosféricos na América do Sul. Dimetilamina pode contribuir para sua formação. Marvinbikolano [CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons.
Aerossóis atmosféricos na América do Sul. Dimetilamina pode contribuir para sua formação. Marvinbikolano [CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Fonte: Wikimedia Commons. Referências
- OU.S. Biblioteca Nacional de Medicina. (2019). Dimetilamina. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Kirk-Othmer (1994). Enciclopédia de tecnologia química. Quarta edição. John Wiley & Sons.
- Morrison, r.T. e boyd, r.N. (2002). Química orgânica. 6ª edição. Prentice-Hall.
- Windholz, m. et al. (Editores) (1983). O índice Merck. Uma eniclopédia de produtos químicos, medicamentos e biológicos. Décima edição. Merck & co., Inc.
- Abramowitz, m.K. et al. (2010). A fisiopatologia da uremia. Aminas alifáticas. Em doença renal crônica, diálise e transplante (terceira edição). Recuperado de cientedirect.com.
- Li, h. et al. (2019). Influência de condições atmosféricas na nova formação de partículas à base de ácido sulfúrico-dimetilamina-amônia. Chosfer 2019; 245: 125554. NCBI se recuperou.Nlm.NIH.Gov.
- Mackie, J.C. e Kennedy, e.M. (2019). Pirólise de glifosato e músicas produtos tóxicos. Ambiente. Sci. Technol. 2019: 53 (23): 13742-13747. NCBI se recuperou.Nlm.NIH.Gov.

