Propriedades de Dibenzalacetona, mecanismo de reação, usos, riscos

- 2447
- 258
- Conrad Schmidt
O Dibenzalacetona (DBA) é um composto orgânico cuja fórmula molecular é C17H14QUALQUER. É um sólido amarelado que, dependendo de sua pureza, pode ser apresentado como cristais. É usado em filtros solares e síntese organometal na qual o paládio é usado como catalisador.
Embora sua síntese seja um processo relativamente simples e bastante recorrente no ensino de laboratórios para explicar a condensação aldólica, seu mecanismo é um pouco extenso, vários fatores devem ser levados em consideração. O benzaldeído que é usado, que se condensará com acetona, deve ser recentemente destilado para garantir sua baixa oxidação em contato com o ar.
 Amostra de dibenzalacetona em recipiente de vidro. Fonte: Stephanb [CC BY-SA (http: // criativeCommons.Org/licenças/BY-SA/3.0/]]
Amostra de dibenzalacetona em recipiente de vidro. Fonte: Stephanb [CC BY-SA (http: // criativeCommons.Org/licenças/BY-SA/3.0/]] Da mesma forma, um meio de etanol-água é usado para solubilizar os reagentes e, ao mesmo tempo, promover a precipitação final da dibenzalacetona, composto hidrofóbico e insolúvel. Até agora, não se sabe quais efeitos negativos podem exercer dibenzalaceton no organismo ou no meio ambiente, em vez de ser uma substância irritante.
[TOC]
Propriedades
Aspecto físico
Aparência emergente amarelada sólida ou cristalina.
Massa molar
234,29 g/mol
Isômeros
A dibenzalacetona é apresentada como três isômeros geométricos: trans-trans-trans-cis e cis-cis. O isômero trans-trans é o mais estável e, portanto, aquele que mais ocorre durante a síntese.
Ponto de fusão
110-111 ºC. Esse intervalo varia dependendo do grau de pureza do sólido sintetizado.
Solubilidade em água
Insolúvel.
Estrutura
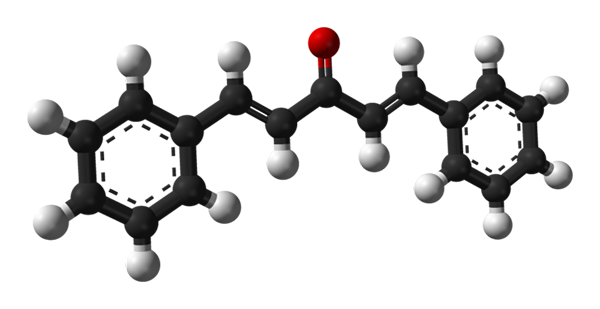 Estrutura molecular da dibenzalacetona. Fonte: Benjah-BMM27 [Domínio Público]
Estrutura molecular da dibenzalacetona. Fonte: Benjah-BMM27 [Domínio Público] Na imagem superior, a molécula do isômero trans-trans-trans é mostrada. No centro, temos o grupo carbonil e, em seus lados, ligações duplas e dois anéis aromáticos do Bonenceno.
Dibenzalacetona está na essência apolar e hidrofóbica, uma vez que toda a sua estrutura é praticamente composta de átomos de carbono e hidrogênio. O grupo carbonil dá apenas um pequeno momento dipolar.
Pode atendê -lo: fosfuro de alumínio (AIP): estrutura, propriedades, usos, riscosA estrutura pode ser equiparada à de uma folha, uma vez que todos os seus átomos de carbono têm hibridação SP2; Portanto, eles descansam no mesmo avião.
Os fótons leves interagem com o sistema π conjugado do dibenzalacetona; especialmente os da radiação UV, sendo absorvidos para excitar elétrons realocados. Esta propriedade faz de Dibenzalacetona um excelente absorvente de luz ultravioleta.
Mecanismo de reação de dibenzalacetona
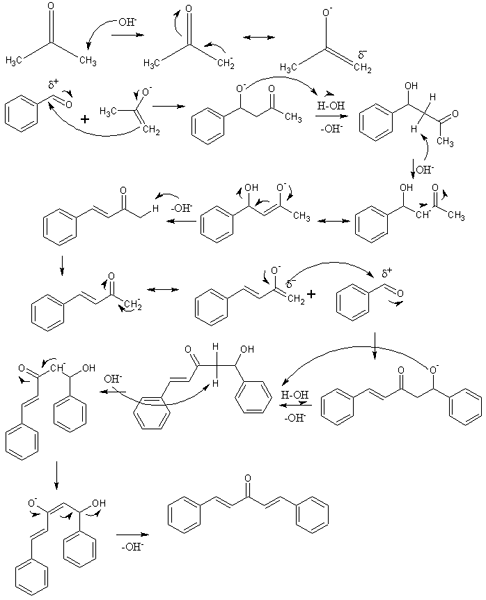 Mecanismo de condensação aldólica na síntese de dibenzalacetona. Fonte: Izmaelt [CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]
Mecanismo de condensação aldólica na síntese de dibenzalacetona. Fonte: Izmaelt [CC BY-S (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] Na imagem superior, representamos o mecanismo de condensação aldólica entre benzaldeído e acetona, para originar a dibenzalacetona; especificamente, seu isômero trans-trans.
A reação começa com acetona em meio básico. OH- UNSWIDE UM PROTON ÁCIDO DE AMER seus dois grupos metilo, -Ch3, dando origem a um inolado: Cho3C (O) CH2-, que realoca sua carga de ressonância negativa (primeira linha da imagem).
Este inolado então atua como um agente nucleofílico: ataca o grupo carbonil de uma molécula de benzaldeído. Sua incorporação no benzaldeído gera um alcoxide, que porque é muito básico devastador uma molécula de água e se torna um aldol (segunda fila). O aldol ou β-hidroxiciton é caracterizado por ter grupos C = O e OH.
O meio básico desidrata esse aldol e uma ligação dupla é formada em sua estrutura, que gera a benzilideneactona (terceira linha). Então, oh- Também desprovido de um de seus hidrogênios ácidos, repetindo outro ataque nucleofílico a uma segunda molécula de benzaldeído. Desta vez, o ataque ocorre tão rapidamente (quarta fila).
O produto formou não protegido outra molécula de água e sofre novamente uma desidratação para eliminar o grupo OH e estabelecer uma segunda vínculo duplo (quinta e sexta filas). Assim e, finalmente, o dibenzalacetona ocorre.
Pode servir você: Boyle LawSíntese
Reagentes
Os reagentes para realizar a síntese da dibenzalacetona são os seguintes:
- 95% de etanol.
- Benzaldeído recém -destilado de óleo de amêndoa amarga.
- Naoh como um catalisador básico em água destilada.
As quantidades a serem usadas dependem de quanta diBenzalacetona é destinada a sintetizar. No entanto, há um excesso de benzaldeído, porque parte dele é oxidada ao ácido benzóico. Também é garantido que a reação leva menos tempo e que a indesejável benzilideneactona seja produzida em menor grau.
O etanol atua como um solvente de benzaldeído, pois, caso contrário, não se dissolveria no ambiente básico de Naoh.
Procedimento
Em um grande vidro precipitado, o etanol é misturado com benzaldeído. Então o meio básico de NaOH é adicionado durante a agitação magnética constante. Nesta etapa, a reação cannizzaro ocorre; Isto é, duas moléculas de benzaldeído se desproporam em um de álcool benzílico e outro de ácido benzóico, facilmente reconhecível por seu cheiro doce característico.
Finalmente, a acetona é adicionada e meia hora é esperada para que a solução fique nublada e uma cor amarela-laranja. Dibenzalacetona precipitará devido à água, portanto, um volume considerável de água é adicionado para promover sua precipitação completa.
Dibenzalacetona filtra em um vácuo e seu sólido amarelado foi lava várias vezes com água destilada.
Recristalização
 Uma amostra recristalizada de dibenzalacetona deve usar um brilho semelhante ao dos cristais desta imagem. Fonte: Smokefoot [CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]
Uma amostra recristalizada de dibenzalacetona deve usar um brilho semelhante ao dos cristais desta imagem. Fonte: Smokefoot [CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] Para purificar dibenzalacetona, é usado etanol a 95% ou acetato de etila quente, para que mais cristais de pureza sejam obtidos para cada vez que a recristalização é repetida. Assim, a poeira amarelada inicial será transformada em pequenos cristais amarelos de dibenzalacetona.
Pode atendê -lo: ácido benzóico (C6H5cooh)Formulários
Dibenzalacetona é um composto que não tem muitos usos. Devido à sua capacidade de absorver a luz ultravioleta, ela é usada na formulação de protetor solar ou em qualquer outro produto que colate a incidência de raios UV, revestimentos ou pinturas.
Por outro lado, a dibenzalacetona é usada na síntese organometálica do paládio. Ele atua como uma ligação que coordena os átomos metálicos do paládio, PD0, Para formar o complexo Tris (Dibenzeneactona) Dipaladio (0).
Este composto organometálico fornece átomos de PD0 Em diferentes síntese orgânica, por isso se comporta como um catalisador homogêneo, pois se dissolve em muitos solventes orgânicos.
Da mesma forma, Dibenzalacetona como fichário é fácil de substituir por outros ligantes orgânicos, o que permite que a síntese organometálica do paládio se desenvolva.
Riscos
Em relação aos riscos, não há muitas informações disponíveis que relatam os possíveis impactos em relação à saúde ou ao meio ambiente que podem levar à dibenzalacetona. Em seu estado puro, é um sólido irritante para ingestão, respiração ou contato direto com os olhos ou a pele.
No entanto, aparentemente não é irritante o suficiente para que não possa fazer parte das formulações de filtros solares. Por outro lado, sendo tão insolúvel em água, sua concentração é insignificante, apresentando -se como um contaminante sólido. Nesse sentido, não se sabe o quão prejudicial é para a fauna marinha ou solo a turbidez que causa.
Até que o oposto seja demonstrado.
Referências
- Morrison, r. T. e boyd, r, n. (1987). Quimica Organica. 5ª edição. Interamericano Editorial Addison-Wesley.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. (10ª edição.). Wiley Plus.
- Wikipedia. (2020). Dibenzilideneacetona. Recuperado de: em.Wikipedia.org
- Centro Nacional de Informações sobre Biotecnologia. (2020). Dibenzilideneacetona. Banco de dados PubChem., CID = 640180. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Sintetes orgânicas. (2020). Dibenzalacetona. Recuperado de: Orsyn.org
- Dibenzalacetona por condensação de Aldol. Recuperado de: web.Mnstate.Edu
- « Características de poluição térmica, consequências, exemplos
- Fundamentos da iodometria, reações, procedimento geral, usos »

