Desnaturação de proteínas O que é, fatores, consequências
- 4437
- 219
- Tim Mann
Qual é a desnaturação de proteínas?
O desnaturação de proteínas Consiste na perda de estrutura tridimensional devido a diferentes fatores ambientais, como temperatura, pH ou certos agentes químicos. A perda da estrutura resulta na perda da função biológica associada a essa proteína, seja enzimática, estrutural, transportador, entre outros.
A estrutura da proteína é altamente sensível a mudanças. A desestabilização de uma única ponte essencial de hidrogênio pode desnaturalizar a proteína. Da mesma forma, existem interações que não são estritamente essenciais para cumprir a função proteica e, em caso de ser desestabilizado, isso não tem efeito na operação.
Estrutura de proteínas
Para entender os processos de desnaturação de proteínas, devemos saber como as proteínas são organizadas. Estes têm estrutura primária, secundária, terciária e quaternária.
Estrutura primária
É a sequência de aminoácidos que compõe esta proteína. Aminoácidos são os blocos fundamentais que constituem essas biomoléculas e existem 20 tipos diferentes, cada um com propriedades físicas e químicas específicas. Eles se juntam por meio de um link peptídico.
Estrutura secundária
Nesta estrutura, essa cadeia linear de aminoácidos começa a ser dobrada por pontes de hidrogênio. Existem duas estruturas secundárias básicas: a hélice α, em forma de espiral; e a folha dobrável β, quando duas cadeias lineares estão alinhadas em paralelo.
Estrutura terciária
Envolve outros tipos de forças que resultam em dobragem específica da forma tridimensional.
As cadeias R de resíduos de aminoácidos que compõem a estrutura da proteína podem formar pontes dissulfeto e as partes hidrofóbicas das proteínas são agrupadas no interior, enquanto hidrofilicas enfrentam a água na água. As forças de van der Waals atuam como um estabilizador das interações descritas.
Pode atendê -lo: isoleucina: características, funções, biossíntese, comidaEstrutura quaternária
Consiste em agregados de unidades de proteína.
Quando uma proteína é desnaturada, perde a estrutura quaternária, terciária e secundária, enquanto o primário permanece intacto. Proteínas ricas em links dissulfeto (estrutura terciária) fornecem maior resistência à desnaturação.
Fatores que causam desnaturação
Qualquer fator que desestabilize as ligações não -covalentes responsáveis por manter a estrutura nativa da proteína pode produzir sua desnaturação. Entre os mais importantes que podemos mencionar:
ph
Em valores de pH muito extremos, sejam meios ácidos ou básicos, a proteína pode perder sua configuração tridimensional. O excesso de sons h+ e oh- No meio desencadeia as interações proteicas.
Essa mudança de padrão de íons produz desnaturação. A desnaturação do pH pode ser reversível em alguns casos e em outros irreversíveis.
Temperatura
A desnaturação térmica ocorre aumentando a temperatura. Nos organismos que vivem em condições ambientais médias, as proteínas começam a desestabilizar a temperaturas maiores que 40 ° C. Claramente, as proteínas do organismo termofílico podem suportar essas faixas de temperatura.
Os aumentos de temperatura são traduzidos em aumento de movimentos moleculares que afetam as pontes de hidrogênio e outras ligações não -covalentes, resultando na perda de estrutura terciária.
Esses aumentos de temperatura levam à velocidade da reação, se estamos falando de enzimas.
Substancias quimicas
Substâncias polares - como a uréia - em altas concentrações, afetam as pontes de hidrogênio. Da mesma forma, substâncias não polares podem ter consequências semelhantes.
Os detergentes também podem desestabilizar a estrutura da proteína; No entanto, não é um processo agressivo e eles são principalmente reversíveis.
Pode servir a você: barata alemã: características, reprodução, comidaAgentes redutores
Β-mercaptoetanol (hoch2ch2sh) é um agente químico de uso frequente no laboratório para desnaturalizar proteínas. É responsável por reduzir as pontes de dissulfeto entre resíduos de aminoácidos. Pode desestabilizar a estrutura terciária ou quaternária da proteína.
Outro agente redutor com funções semelhantes é o ditiotreitol (DTT). Além disso, outros fatores que contribuem para a perda de estrutura nativa em proteínas são metais pesados em altas concentrações e radiação ultravioleta.
Conseqüências do desnaturação de proteínas
Quando a desnaturalização ocorre, a proteína perde sua função. As proteínas funcionam de maneira ideal quando estão em seu estado nativo.
A perda da função nem sempre está associada a um processo de desnaturação. Uma pequena mudança na estrutura da proteína pode levar à perda de função sem desestabilizar toda a estrutura tridimensional tridimensional.
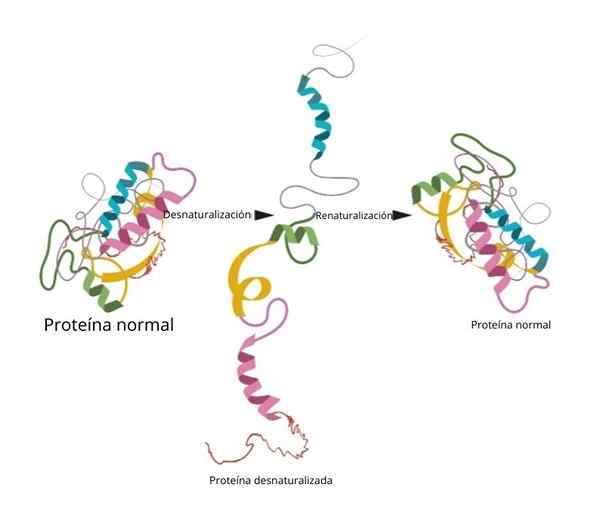
O processo pode ou não ser irreversível. No laboratório, se as condições forem revertidas de que a proteína retornar à sua configuração inicial.
Renaturalização
Um dos experimentos mais famosos e conclusivos sobre renaturalização foi evidenciado na ribonuclease para.
Quando os pesquisadores adicionaram agentes desnaturadores como uréia ou β-mercaptanol, a proteína foi desnaturada. Se esses agentes fossem removidos, a proteína retornou à sua conformação nativa e poderia desempenhar sua função com uma eficiência de 100 %.
Uma das conclusões mais importantes desta pesquisa foi demonstrar experimentalmente que a conformação tridimensional da proteína é dada por sua estrutura primária.
Em alguns casos, o processo de desnaturalização é totalmente irreversível. Por exemplo, quando cozinhamos um ovo, estamos aplicando calor em proteínas (a principal é albumina) que o constituem, o claro é uma aparência sólida e esbranquiçada. Intuitivamente pode concluir que, embora o esfriemos, ele não retornará à sua forma inicial.
Pode atendê -lo: ovogênese: fases, características em animais e plantasNa maioria dos casos, o processo de desnaturalização é acompanhado pela perda de solubilidade. Viscosidade, velocidade de difusão também é reduzida e cristaliza mais facilmente.
Proteínas chaperonas
Chaperonas ou proteínas de chaperonina são responsáveis por impedir a desnaturação de outras proteínas. Eles também reprimem certas interações que não são adequadas entre as proteínas para garantir uma dobra correta delas.
Quando a temperatura média aumenta, essas proteínas aumentam sua concentração e agem impedindo a desnaturação de outras proteínas. É por isso que eles também são chamados de "proteínas de choque térmico" ou HSP para sua sigla em inglês (Proteínas de choque térmico).
As acomodações são análogas a uma gaiola ou barril que protege a proteína de interesse dentro.
Essas proteínas que respondem a situações de estresse celular foram relatadas em vários grupos de organismos vivos e são altamente preservados. Existem diferentes tipos de acompanhantes e são classificados de acordo com seu peso molecular.

