Defeitos específicos
- 3786
- 547
- Orlando MacGyver
O que são defeitos específicos?
Defeitos pontuais são imperfeições ou irregularidades que são apresentadas no retículo cristalino de um sólido, e que desviam a estrutura cristalina de seu status perfeito. Dizem que eles não têm dimensão (0) porque são apenas pontos do retículo cristalino; Este ponto pode ser um átomo, íon, molécula, grupos, etc.
Os sólidos a uma temperatura de 0 K (Zero Absoluto) exibem estruturas perfeitas, porque, em teoria, seus componentes são imobilizados, congelados. No entanto, os átomos mal são carregados, para dizer, eles começam a vibrar, que mais cedo ou mais tarde acabam se movendo para fora de seus sites correspondentes.
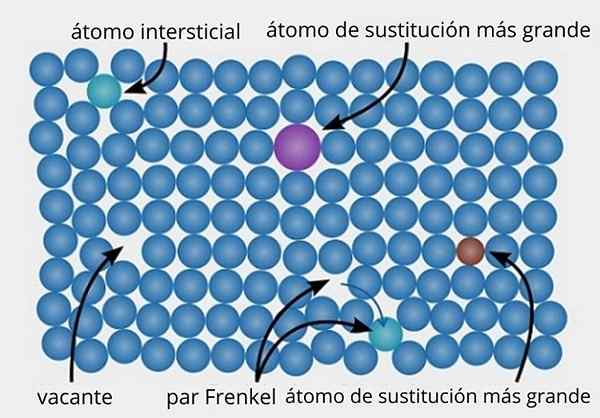
 Representação de vários tipos de defeitos específicos encontrados em sólidos cristalinos. Fonte: Daniferi, CC BY-SA 3.0, via Wikimedia Commons
Representação de vários tipos de defeitos específicos encontrados em sólidos cristalinos. Fonte: Daniferi, CC BY-SA 3.0, via Wikimedia Commons Vamos ver a imagem superior como um exemplo. Em uma estrutura cristalina ordenada e perfeita, todos os pontos azulados devem ser alinhados. No entanto, alguns dos pontos azulados podem estar ausentes, o que é observado pela presença de um espaço vazio ou uma vaga.
Se a formação da referida vaga for devida ao deslocamento de um ponto azulado de seu site original, teremos um par de frenkel, um dos principais tipos de defeitos específicos que existem. O ponto azulado mobilizado está agora em uma posição intersticial (verde).
Por outro lado, defeitos específicos também podem ser devidos a substituições, por átomos maiores (roxos) ou átomos menores (marrons) (marrom). Falamos sobre defeitos específicos substitucionais, que ocorrem muitas vezes quando as impurezas são introduzidas de propósito (dopped) em materiais de metal e cerâmica.
Defeitos pontuais são essenciais para entender outros defeitos que são projetados em outras dimensões de vidro.
Defeitos específicos intrínsecos
Quando uma estrutura cristalina é sempre definida, ela é sempre feita a partir da idealidade. Mas na natureza os defeitos são inevitáveis, por mais pequenos que sejam. Assim, os sólidos têm uma predisposição natural para apresentar defeitos específicos em suas estruturas, cuja interação e soma afetam ou modificam suas propriedades químicas e físicas. Os defeitos específicos intrínsecos de So -chamados ocorrem em materiais "puros".
Esta predisposição natural é devida a fatores termodinâmicos e cinéticos. A introdução de defeitos aumenta a entropia do sólido, que por sua vez aumenta com a temperatura. Então, a uma certa temperatura, qualquer sólido terá um estado com uma configuração mínima de defeitos específicos.
À medida que a temperatura aumenta, haverá ainda mais defeitos, tendo a quantidade máxima possível nas proximidades do ponto de fusão. Tudo isso faz sentido, se se pensa que para vibrações térmicas mais altas, maiores serão as chances de que os átomos abandonem suas respectivas posições reticulares.
Defeitos extrínsecos de pontos
Ao contrário de defeitos específicos intrínsecos, os extrínsecos ocorrem devido à incorporação de impurezas. Nenhuma natureza sólida é 100% pura, portanto, esses tipos de defeitos sempre se manifestam, além de intrínseco.
Pode atendê -lo: ácido glucônico: estrutura, propriedades, síntese, usosNo entanto, eles cobram uma importância e interesse únicos quando as impurezas são intencionalmente adicionadas nas quantidades padrão; Falamos sobre o material idiota.
Dependendo das características do Doponte e do material selecionado, os defeitos são incorporados ao sólido de maneira premeditada, o que tem um impacto em suas propriedades químicas e físicas. É o caso da formulação de semicondutores, por exemplo, os gaas.
Por outro lado, defeitos específicos extrínsecos também aludem àqueles que modificam a composição de materiais ou sólidos. Isto é, eles perdem sua estequiometria para se tornarem não -estoquiométricos sólidos.
Defeitos de metal pontual
Em metais, temos cristais que, em princípio, carecem de cargas elétricas; isto é, não há cátions ou ânions presentes, mas apenas átomos neutros de metal. Portanto, os defeitos que poderiam estar em metais não afetariam sua neutralidade, portanto, nenhum mecanismo não teria mecanismo que compensa esses defeitos.
 Defeitos específicos intrínsecos em cristais de um metal hipotético. Fonte: Gabriel Bolívar.
Defeitos específicos intrínsecos em cristais de um metal hipotético. Fonte: Gabriel Bolívar. Na imagem acima, temos um cristal perfeito e outros dois com defeitos. Os átomos podem estar localizados em posições intersticiais, que transtoram as posições dos átomos vizinhos e são conhecidos como defeito auto-interstacional (abaixo no centro). Enquanto isso, alguns átomos são capazes de abandonar seus respectivos locais do arranjo cristalino para gerar vagas (à direita).
Portanto, em metais puros, a existência de defeitos intrínsecos de vagas e auto-intersticiais é possível. Quanto mais vaga lá, a densidade da substância diminui; fato que está alinhado com o aumento do número de defeitos com a temperatura.
Quando, por outro lado, o metal com átomos de outro elemento é dado, eles causam substituições ou procuram se colocar nos interstícios. Nesses casos, a densidade do metal aumenta para um valor máximo, do qual começa a diminuir drasticamente.
Defeitos específicos em estruturas cristalinas
Nas estruturas cristalinas, cobrindo outros sólidos, além dos metais mencionados, temos dois tipos principais de defeitos específicos: os de Frenkel e os de Schottky. Ambos podem ocorrer nas mesmas regiões de um cristal, e também é bem possível que estejam presentes juntamente com defeitos de vagas ou ocupações intersticiais.
Quando falamos de sais, óxidos, sulfatos, etc., Haverá cátions e ânions que definem um cristal para suas interações eletrostáticas. Portanto, se eliminarmos um cátion, as cargas negativas dos ânions predominarão e o vidro será carregado negativamente. Isso é impossível de ocorrer porque violaria o princípio da eletroneutralidade.
Assim, os defeitos nesse tipo de cristais geram cargas elétricas, que por meio de um mecanismo devem ser correspondidas novamente. No entanto, os defeitos de Frenkel e Schottky não produzem esse desequilíbrio de cargas elétricas.
Pode atendê -lo: ponto de equivalênciaFrenkel
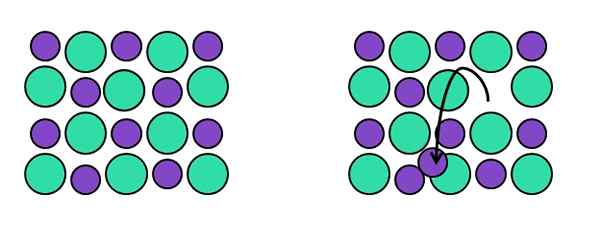 Representação de defeitos pontuais de Frenkel. Fonte: Gabriel Bolívar.
Representação de defeitos pontuais de Frenkel. Fonte: Gabriel Bolívar. Fazenda -Ran -Time Frenkel, em homenagem a Yakov Frenkel, um ponto reticular deixa sua posição original para terminar em um interstício. Ou seja, um átomo, molécula ou íons passam para uma posição intersticial, deixando para trás uma vaga.
Veja o exemplo da imagem acima. À esquerda, temos o cristal perfeito composto por dois íons: um verde, que ordenados ao ânion (mais volumoso) e um roxo, que se torna o cátion (menor).
Quando um dos cátions roxos deixa sua posição do arranjo cristalino, deixa uma vaga para trás. Nota à esquerda, a direção em que a seta preta aponta, apontando que o cátion está agora localizado em um interstício.
Como o defeito de Frenkel consiste em deslocamentos de cátions (ou ânions), o vidro permanece neutro. Além disso, a composição do vidro permanece constante, pois no retículo os íons estão mudando de posição: eles não estão abandonando, nem outros estão adicionando a ele.
Schottky
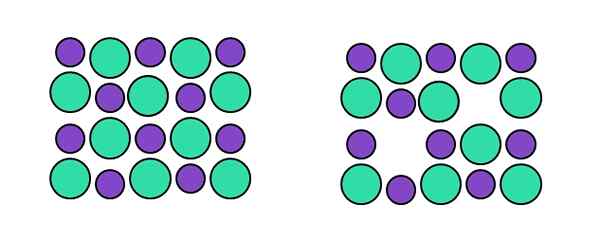 Representação do defeito Schottky. Fonte: Gabriel Bolívar.
Representação do defeito Schottky. Fonte: Gabriel Bolívar. No tipo Schoottky específico, temos duas vagas simultâneas: uma correspondente ao cátion e outra correspondente ao ânion. Por exemplo, não se trata de um cátion para brilhar uma posição intersticial, mas que "desaparece" acompanhada por um ânion (direito da imagem superior).
Novamente, quando duas vagas são criadas ao mesmo tempo, um catiônico (que se comportará como um ânion) e um aniônico (que se comportará como um cátion), a composição do cristal permanece inalterada. É assim que esse tipo de defeito estiver falando, e não as vagas arbitrárias causadas por agentes externos ou internos.
De tudo isso acima, conclui -se que os defeitos de Frenkel e Shottky são defeitos estequiométricos de ponta intrínseca, uma vez que eles não alteram a composição ou estequiometria de sólidos.
Defeitos pontuais em materiais de cerâmica
A cerâmica são materiais cujo caráter iônico é muito oscilante. Alguns apresentam um caráter covalente acentuado, como na sílica, Sio2, ou com nituro de alumínio, ALN.
Portanto, devemos considerar dois outros tipos de defeitos específicos que podem ocorrer como um produto da natureza covalente da cerâmica: o antisitium e o link não saturado.
Antisitium
Como o próprio nome sugere, é o defeito que ocorre quando dois átomos mudam de site, estando em posições contrárias às do retículo cristalino original. Por exemplo, no sic, pode acontecer que existam C-C ou Si-se. Esse tipo de defeito pontual também é muito comum em ligas:
Pode atendê -lo: fosfuro de alumínio (AIP): estrutura, propriedades, usos, riscos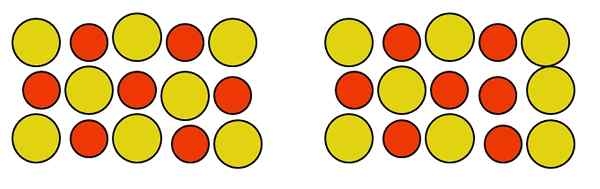 Defeito de Antisitium Pontual em uma liga Au-Cu. Fonte: Gabriel Bolívar.
Defeito de Antisitium Pontual em uma liga Au-Cu. Fonte: Gabriel Bolívar. Observe que os átomos de cobre e ouro na liga Au-How são neutros. Não importa como eles se movem, a neutralidade do vidro não é perturbada. Portanto, os dois átomos mudam de local no vidro, como na direita da imagem acima, não afeta a neutralidade da liga.
Em cerâmicas que têm mais de um cátion, como espinha, dois cátions com valências iguais podem trocar o site (por exemplo3+ e cr3+) sem o desequilíbrio de cargas elétricas.
Link não saturado
O link não saturado (vínculo pendurado em inglês) interrompe a ordem nos cristais da cerâmica covalente, uma vez que o átomo que forma o link está ausente, deixando alguns elétrons gratuitos.
Na cerâmica, não apenas os defeitos de anti -itium e link não saturado, mas também todos os defeitos intrínsecos e extrínsecos, por isso é complexo analisar suas estruturas reais, não perfeitas.
Exemplos de defeitos específicos
Ao longo do artigo, alguns exemplos de materiais e seus defeitos específicos foram mencionados. Em seguida, e finalmente, outros materiais serão listados, acompanhados pelo tipo de defeito que geralmente apresentam.
Halogenetos de prata
Halogenetos de prata, como AGCL ou AGBR, apresentam defeitos de Frenkel onde a agência+ Se move para posições intersticiais.
Haluros alcalinos
Os halogenetos alcalinos, como NaCl, manifestam defeitos schottky, cujas vagas aniônicas são preenchidas com elétrons quando seus cristais são aquecidos na presença de sódio ou vapores de potássio metálico.
Dioxido de Torio
No tho2 O cátion th4+ é mais volumoso que o ânion ou2-. Portanto, esse óxido tem um defeito de Frenkel onde está o2- quem se muda para posições intersticiais.
Paladio Sponge
O paládio é capaz de absorver hidrogênio, comportando -se como uma esponja que os retém nas posições intersticiais de seus cristais.
Aça
Da mesma forma que acontece entre o Paladium e o hidrogênio, o ferro pode incorporar átomos de carbono em seus interstícios, o que resulta na formação de aços.
Ligas de titânio
O defeito pontual da substituição, embora não tenha sido explicado como os outros defeitos, nada mais é do que a substituição de um átomo para outro, que quebra com a ordem estabelecida pelo cristal.
Assim, por exemplo, átomos de um cristal de titânio podem ser substituídos por outros átomos (metálicos) para causar uma família de ligas de titânio.
Referências
- Barry Carter & M. Grant Norton. (2007). Ciência e Engenharia de Materiais de Cerâmica. Springer.
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- B.S.H. Royce. (s.F.). Defeitos pontuais. Recuperado de: Princeton.Edu
- Wikipedia. (2020). Defeito cristalográfico. Recuperado de: em.Wikipedia.org
- Nayak, s.K., Pendurado, c.J., Sharma, v. et al. (2018). Insight sobre defeitos pontuais e impurezas no titânio dos primeiros princípios.NPJ Computer MA 4.11. doi.org/10.1038/S41524-018-0068-9
- Byju's. (2020). Defeitos pontuais. Recuperado de: byjus.com

